名校
解题方法
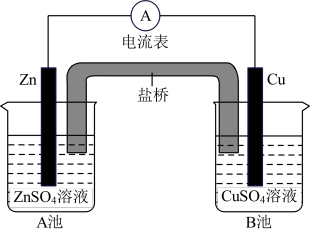
1 . 某学生利用下面实验装置探究盐桥式原电池的工作原理。

按照实验步骤依次回答下列问题:
(1)导线中电子流向为___________ (用a、b表示)。
(2)写出装置中锌电极上的电极反应式:___________ 。
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为___________ 。
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是___________ 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的___________ (填代号)。
A.NaOH B.Zn C.Fe D.H2SO4

按照实验步骤依次回答下列问题:
(1)导线中电子流向为
(2)写出装置中锌电极上的电极反应式:
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的
A.NaOH B.Zn C.Fe D.H2SO4
您最近一年使用:0次
2021-01-09更新
|
147次组卷
|
2卷引用:甘肃省天水市秦安县第一中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
2 . 锌、铜是高中阶段常见的两种金属。
(1)如图所示为锌铜原电池。
①盐桥装有饱和KCl溶液的琼脂,原电池工作时K+的移动方向是___ (填“锌电极”或“铜电极”)
②外电路中有0.2mol电子通过时,铜片表面增重___ g。
(2)如图是一个电解过程示意图。
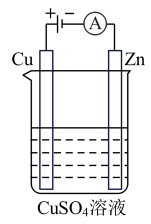
①锌片上发生的电极反应式是:___ 。
②电解过程中,铜电极质量减少为128g,则硫酸铜溶液浓度___ (填“增大”、“减小”或“不变”),电路中通过的电子数目为___ 。
(3)100mL0.200mol·L−1CuSO4溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为4.18J·g−1·℃−1、溶液的密度均近似为1.00g·cm−3,忽略溶液体积、溶液质量变化和金属吸收的热量)。请计算:
①反应放出的热量Q=___ J。
②反应Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)的ΔH=____ kJ·mol−1。
(1)如图所示为锌铜原电池。
①盐桥装有饱和KCl溶液的琼脂,原电池工作时K+的移动方向是

②外电路中有0.2mol电子通过时,铜片表面增重
(2)如图是一个电解过程示意图。

①锌片上发生的电极反应式是:
②电解过程中,铜电极质量减少为128g,则硫酸铜溶液浓度
(3)100mL0.200mol·L−1CuSO4溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。(已知:反应前后,溶液的比热容均近似为4.18J·g−1·℃−1、溶液的密度均近似为1.00g·cm−3,忽略溶液体积、溶液质量变化和金属吸收的热量)。请计算:
①反应放出的热量Q=
②反应Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)的ΔH=
您最近一年使用:0次
3 . 铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq)  2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________ (填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____ 极,电子从_____ 极流向____ 极。
(3)写出负极的电极方程式:_____________________________________ 。
 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:(1)放电时,电解质溶液的pH
(2)放电时,电解质溶液中阴离子移向
(3)写出负极的电极方程式:
您最近一年使用:0次
4 . 按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________ 极移动(填“正”或“负”)。
②电子流动方向由____________ 极流向____________ 极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________ g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________ (填“锌极”或“铜极”),原因是_____________ (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________ 。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:__________ 。
③下列叙述中能说明上述反应达到平衡状态的是____________________________ 。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向
②电子流动方向由
③若有1mol e- 流过导线,则理论上负极质量减少
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)
 bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为a∶b∶c=
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
您最近一年使用:0次
2018-09-22更新
|
476次组卷
|
5卷引用:天津市部分区2017~2018学年高一下学期期末考试化学试题
天津市部分区2017~2018学年高一下学期期末考试化学试题(已下线)2019年4月14日《每日一题》 必修2 每周一测新疆兵团第二师华山中学2018-2019学年高一下学期期中考试化学试题河北省张家口市第一中学西校区、万全中学2019-2020学年高二第一学期期初考试化学试题(已下线)【南昌新东方】2019 八一中学、洪都中学、麻丘高中等七校 高一下 期末
名校
解题方法
5 . 2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2 (g)、CO2(g)和H2O(l)的热化学方程式______________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①下列说法不能作为判断该反应达到化学平衡状态标志的是___________ ;
A.活性炭的质量 B.v正(N2) = 2v逆(NO) C.容器内压强保持不变 D.容器内混合气体的密度保持不变 E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
②在T℃时,该反应的平衡常数为______________ (小数点后保留两位);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________ ;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______ (填“正向移动”、“逆向移动”或“不移动”)。
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
①A电极的电极反应式为________________ 。
②下列关于该电池的说法正确的是________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2 (g)、CO2(g)和H2O(l)的热化学方程式
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:| NO | N2 | CO2 | |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是
A.活性炭的质量 B.v正(N2) = 2v逆(NO) C.容器内压强保持不变 D.容器内混合气体的密度保持不变 E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
②在T℃时,该反应的平衡常数为
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
您最近一年使用:0次
2017-04-08更新
|
1644次组卷
|
4卷引用:2017年普通高等学校招生全国统一考试(新课标Ⅰ)猜题卷(二)理科综合化学试卷
10-11高三上·黑龙江·期中
名校
解题方法
6 . I.某同学设计实验探究构成原电池的条件,装置如下:
(1)实验一:实验探究电极的构成〈甲图〉
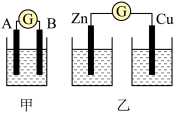
①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一:____________________________________ 。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________ 。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________ 。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(2)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______ 偏转。
(3)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______ (填“能”或“不能”)偏转。
II.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
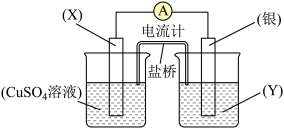
请回答下列问题:
(4)电极X的材料是_________ ;电解质溶液Y是_________ ;
(5)当电路中转移0.01mol电子时,两电极的质量差为______ g。
(1)实验一:实验探究电极的构成〈甲图〉

①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一:
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(2)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向
(3)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针
II.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。

请回答下列问题:
(4)电极X的材料是
(5)当电路中转移0.01mol电子时,两电极的质量差为
您最近一年使用:0次
10-11高二上·江西新余·阶段练习
解题方法
7 . 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒,当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。

试回答下列问题:
(1)图中通过负载的电子流动方向________ (填“向左”或“向右”)。
(2)写出氢氧燃料电池工作时电极反应方程式:正极:__________ ,负极: _________ 。
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温及催化剂作用下制取氢气,写出C3H8和H2O反应生成H2和CO的化学方程式:_________________ 。
(4)其它条件不变,若将此燃料电池改进为以甲烷和氧气为原料进行工作时,负极反应式为_______ 。

试回答下列问题:
(1)图中通过负载的电子流动方向
(2)写出氢氧燃料电池工作时电极反应方程式:正极:
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温及催化剂作用下制取氢气,写出C3H8和H2O反应生成H2和CO的化学方程式:
(4)其它条件不变,若将此燃料电池改进为以甲烷和氧气为原料进行工作时,负极反应式为
您最近一年使用:0次



