名校
解题方法
1 . 为验证反应 ,利用如图电池装置进行实验。
,利用如图电池装置进行实验。
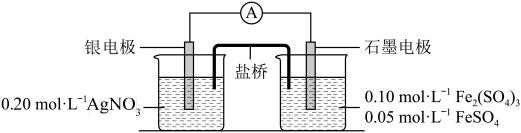
(1)由 固体配制500mL
固体配制500mL
 溶液,需要的仪器有胶头滴管、量筒、烧杯、玻璃棒、药匙、托盘天平、
溶液,需要的仪器有胶头滴管、量筒、烧杯、玻璃棒、药匙、托盘天平、_______ (填写名称);在烧杯中溶解固体时,先加入一定体积的_______ 稀溶液,搅拌后再加入一定体积的水。
(2)电流表显示电流由银电极流向石墨电极。可知,盐桥中的阳离子进入_______ 电极溶液中。
(3)根据(2)实验结果,可知石墨电极的电极反应式为_______ ,银电极的电极反应式为_______ 。因此, 氧化性小于
氧化性小于_______ 。
(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为 ,反应一段时间后,可以观察到电流表指针反转,原因是
,反应一段时间后,可以观察到电流表指针反转,原因是_______ 。
 ,利用如图电池装置进行实验。
,利用如图电池装置进行实验。
(1)由
 固体配制500mL
固体配制500mL
 溶液,需要的仪器有胶头滴管、量筒、烧杯、玻璃棒、药匙、托盘天平、
溶液,需要的仪器有胶头滴管、量筒、烧杯、玻璃棒、药匙、托盘天平、(2)电流表显示电流由银电极流向石墨电极。可知,盐桥中的阳离子进入
(3)根据(2)实验结果,可知石墨电极的电极反应式为
 氧化性小于
氧化性小于(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为
 ,反应一段时间后,可以观察到电流表指针反转,原因是
,反应一段时间后,可以观察到电流表指针反转,原因是
您最近一年使用:0次
2022-12-07更新
|
162次组卷
|
2卷引用:河南郑州外国语学校2022-2023学年高三上学期调研考试2化学试题
解题方法
2 . 请根据有关知识,填写下列空白:
I.完成下列填空
(1)拆开1molH-H键,1molN-H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ。则理论上1molN2生成NH3_______ (填“吸收”或“放出”)热量_______ kJ。
II.某兴趣小组为研究原电池原理,设计如图装置。
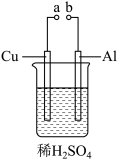
(2)a和b用导线连接,Cu极为原电池_______ 极(填“正”或“负”),电极反应式是:_______ ;Al极发生_______ (填“氧化”或“还原”)反应,其电极反应式为:_______ ,溶液中 移向
移向_______ 。(填“Cu”或“Al”极);当负极金属溶解5.4g时,_______ NA电子通过导线。
(3)若a与电源正极相连,Cu电极反应式为:_______ ; Al电极产生气体为_______ 。
I.完成下列填空
(1)拆开1molH-H键,1molN-H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ。则理论上1molN2生成NH3
II.某兴趣小组为研究原电池原理,设计如图装置。

(2)a和b用导线连接,Cu极为原电池
 移向
移向(3)若a与电源正极相连,Cu电极反应式为:
您最近一年使用:0次
解题方法
3 . 完成下列问题
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,若向一定体积密闭容器中加入1 mol N2和3 mol H2,充分反应后,放出热量
2NH3(g) ΔH=-92.4 kJ·mol-1,若向一定体积密闭容器中加入1 mol N2和3 mol H2,充分反应后,放出热量_______ (填“>”“<”或“=”)92.4 kJ,说明判断的理由。
(2)S(g)+O2(g)=SO2(g) ΔH1<0;S(s)+O2(g)=SO2(g) ΔH2<0,则ΔH1_______ ΔH2。
(3)锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:

①外电路的电流方向是由_______ (填“a”或“b”,下同)极流向_______ 极。
②电池的正极反应式为_______ 。
(4)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池中外电路电子的流动方向为_______ (填“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的pH与工作前相比将_______ (填“增大”“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应为_______ 。
(1)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,若向一定体积密闭容器中加入1 mol N2和3 mol H2,充分反应后,放出热量
2NH3(g) ΔH=-92.4 kJ·mol-1,若向一定体积密闭容器中加入1 mol N2和3 mol H2,充分反应后,放出热量(2)S(g)+O2(g)=SO2(g) ΔH1<0;S(s)+O2(g)=SO2(g) ΔH2<0,则ΔH1
(3)锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:

①外电路的电流方向是由
②电池的正极反应式为
(4)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池中外电路电子的流动方向为
②工作结束后,B电极室溶液的pH与工作前相比将
③A电极附近甲醇发生的电极反应为
您最近一年使用:0次
解题方法
4 . 铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作(放电)时该电池的总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。试根据上述信息判断:
2PbSO4+2H2O。试根据上述信息判断:
(1)铅蓄电池充电时和电源负极相连的材料是_____ 。
(2)工作时,正极反应为_____ 。
(3)工作时,电解质溶液的pH_____ (填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向_____ 极。
(5)电流从_____ (填化学式,下同)极流向_____ 极。
 2PbSO4+2H2O。试根据上述信息判断:
2PbSO4+2H2O。试根据上述信息判断:(1)铅蓄电池充电时和电源负极相连的材料是
(2)工作时,正极反应为
(3)工作时,电解质溶液的pH
(4)工作时,电解质溶液中阴离子移向
(5)电流从
您最近一年使用:0次
5 . 造成大气污染的NOx、SO2主要来自于汽车尾气及工厂废气的排放,对其进行处理是我们研究的重要课题。
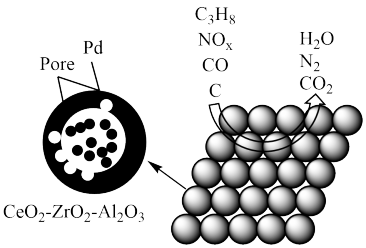
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。
(2)已知:2C(s)+O2(g) 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
则用焦炭还原NO生成无污染气体的热化学方程式为_______ 。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
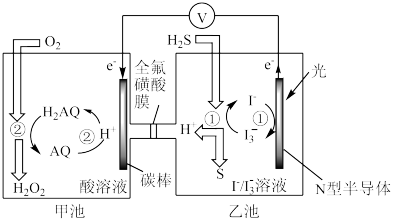
①装置中H+向_______ 池迁移。
②写出乙池溶液中发生反应的离子方程式_______ 。
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为_______ ;现采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_______ (填字母代号)口流出。
②写出阴极的电极反应式:_______ 。
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。

| A.Pd-Pore催化剂可提高尾气净化反应的平衡转化率 |
| B.NOx的生成主要是与汽油燃烧不充分有关 |
| C.在此变化过程中,NOx被还原 |
| D.在催化剂的作用下,CO、NOx、C3H8都转化为无毒的物质 |
 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1N2(g)+O2(g)
 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-12NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1则用焦炭还原NO生成无污染气体的热化学方程式为
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向
②写出乙池溶液中发生反应的离子方程式
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和
 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的
②写出阴极的电极反应式:
您最近一年使用:0次
2022-08-20更新
|
148次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高三上学期期中理科综合化学试题
名校
解题方法
6 . 合理开发利用能源具有重要意义。回答下列问题:
(1)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。
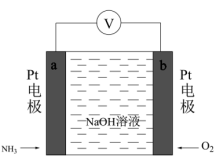
①电极b的名称是___________ ,电子的流动方向为___________ 。
②a极的电极反应式为___________ 。
③电池工作时,理论上反应消耗NH3与O2的物质的量之比为___________ 。
(2)通过如下流程可实现SO2和NO综合处理并获得保险粉( )和硝铵。
)和硝铵。

①装置Ⅲ中生成 与
与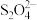 的物质的量之比为
的物质的量之比为___________ 。
②装置Ⅳ中溶液含有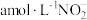 和
和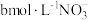 ,欲将cL该溶液完全转化为硝铵,需要通入
,欲将cL该溶液完全转化为硝铵,需要通入 与
与 的体积比为
的体积比为___________ (同温同压下)。
(1)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。

①电极b的名称是
②a极的电极反应式为
③电池工作时,理论上反应消耗NH3与O2的物质的量之比为
(2)通过如下流程可实现SO2和NO综合处理并获得保险粉(
 )和硝铵。
)和硝铵。
①装置Ⅲ中生成
 与
与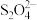 的物质的量之比为
的物质的量之比为②装置Ⅳ中溶液含有
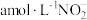 和
和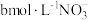 ,欲将cL该溶液完全转化为硝铵,需要通入
,欲将cL该溶液完全转化为硝铵,需要通入 与
与 的体积比为
的体积比为
您最近一年使用:0次
名校
7 . 尿液燃料电池是一种微生物燃料电池,可利用微生物的新陈代谢将有机物转化为无污染气体,同时将化学能转换成电能。利用这种燃料电池既能去除工业废水中的尿素[CO(NH2)2],又能发电。其工作原理如图所示,微生物附着在多孔碳电极上。___________ (填“正极”或“负极”),其电极反应式为___________ ,电子从___________ (填“甲电极”或“乙电极”)流出。
(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO 经过交换膜的移动方向为
经过交换膜的移动方向为___________ (填“由左室移向右室”或“由右室移向左室”);若交换膜为阳离子交换膜,当有 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为___________ g。
(3)该电池中发生反应的总化学方程式为___________ ,该电池不能在高温条件下工作的原因是___________ 。
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量___________ (填“达到”或“未达到”)排放标准(10mg/L),因为废水中尿素的含量为___________ g/L。

(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO
 经过交换膜的移动方向为
经过交换膜的移动方向为 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为(3)该电池中发生反应的总化学方程式为
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量
您最近一年使用:0次
2022-01-21更新
|
108次组卷
|
3卷引用:山西省吕梁市2021-2022学年高二上学期期末考试化学试题
名校
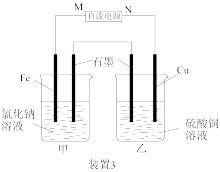
8 . 根据如图所示实验装置,回答相关问题。
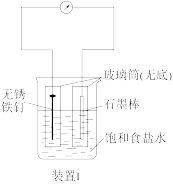
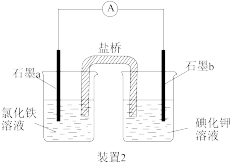
(1)“装置1”中铁钉发生的电化学腐蚀类型为___________ ,石墨电极的电极反应式为___________ 。
(2)“装置2”中外电路电子的移动方向为___________ (填“由a到b”或“由b到a”),该装置发生的总反应的离子方程式为___________ 。
(3)“装置3”中甲烧杯盛有100mL0.2mol/LNaCl溶液,乙烧杯盛有100mL0.5mol/LCuSO4溶液。一段时间后,铜电极增重1.28g。
①直流电源的M端为___________ 极,乙烧杯中电解反应的化学方程式为___________ 。
②装置3产生的气体在标准状况下的体积为___________ mL;欲恢复乙烧杯中的溶液至电解前的状态,可加入___________ (填字母标号)。
a.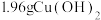 b.1.6gCuO
b.1.6gCuO
c.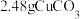 d.
d.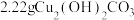



(1)“装置1”中铁钉发生的电化学腐蚀类型为
(2)“装置2”中外电路电子的移动方向为
(3)“装置3”中甲烧杯盛有100mL0.2mol/LNaCl溶液,乙烧杯盛有100mL0.5mol/LCuSO4溶液。一段时间后,铜电极增重1.28g。
①直流电源的M端为
②装置3产生的气体在标准状况下的体积为
a.
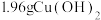 b.1.6gCuO
b.1.6gCuOc.
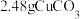 d.
d.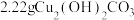
您最近一年使用:0次
2021-11-18更新
|
275次组卷
|
5卷引用:山东省青岛市4区市2021-2022学年高二上学期期中考试化学试题
山东省青岛市4区市2021-2022学年高二上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)山西省阳泉市2022-2023学年高二上学期期末化学试题黑龙江省牡丹江市第二高级中学2023-2024学年高二上学期1月期末化学试题湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题
9 . 反应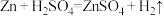 的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100
的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100 相同浓度的稀硫酸中一段时间。回答下列问题:
相同浓度的稀硫酸中一段时间。回答下列问题:
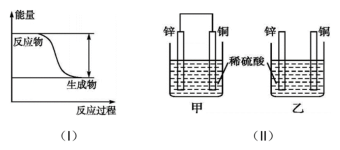
(1)该反应为_______ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_______(填字母)。
(3)下列说法中正确的是_______(填序号)。
(4)在相同时间内,两烧杯中产生气泡的速率:甲_______ 乙(填“>”“<”或“=”)。
(5)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为_______ 。
(6)甲装置构成的原电池中,铜为电池的_______ (填“正”或“负”)极。铜电极上发生的电极反应为_______ 。
(7)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中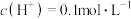 。试确定原稀硫酸中
。试确定原稀硫酸中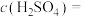
_______ 。
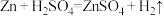 的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100
的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100 相同浓度的稀硫酸中一段时间。回答下列问题:
相同浓度的稀硫酸中一段时间。回答下列问题:
(1)该反应为
(2)若要使该反应的反应速率增大,下列措施可行的是_______(填字母)。
| A.改铁片为铁粉 | B.改稀硫酸为98%的浓硫酸 |
| C.适当升高温度 | D.减小压强 |
| A.甲、乙均为化学能转变为电能的装置 | B.甲装置溶液中 离子向锌极移动 离子向锌极移动 |
| C.甲中铜片质量减小、乙中锌片质量减小 | D.两烧杯中 的浓度均减小 的浓度均减小 |
(5)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为
(6)甲装置构成的原电池中,铜为电池的
(7)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中
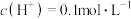 。试确定原稀硫酸中
。试确定原稀硫酸中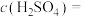
您最近一年使用:0次
名校
解题方法
10 . 综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]可获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:

已知:①常温下,浸出液中各离子的浓度及开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中的金属离子百分数)见表2。
表1 金属离子浓度及开始沉淀的pH
表2金属离子的萃取率
(1)Ga2(Fe2O4)3中Fe的化合价为______ ,“操作1”为______ 。
(2)“滤液1”中可回收利用的物质是______ 。“滤饼”的主要成分是______ 。“萃取”前加入的固体X为______ 。
(3)Ga与Al同主族,化学性质相似。“反萃取”后,镓的存在形式为______ (填化学式)。
(4)GaN可采用“MOCVD(金属有机物化学气相淀积)技术”制得:以合成的三甲基镓[Ga(CH3)3]为原料,在一定条件下使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为______ 。
(5)下图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______ (填“左”或“右”)池移动;铜电极上发生反应的电极反应式为______ 。


已知:①常温下,浸出液中各离子的浓度及开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中的金属离子百分数)见表2。
表1 金属离子浓度及开始沉淀的pH
| 金属离子 | 浓度/mol·L-1) | 开始沉淀的pH |
| Fe2+ | 1.0×10-3 | 8.0 |
| Fe3+ | 4.0×10-2 | 1.7 |
| Zn2+ | 1.5 | 5.5 |
| Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
| 金属离子 | 萃取率/% |
| Fe2+ | 0 |
| Fe3+ | 99 |
| Z2+ | 0 |
| Ga3+ | 97~98.5 |
(1)Ga2(Fe2O4)3中Fe的化合价为
(2)“滤液1”中可回收利用的物质是
(3)Ga与Al同主族,化学性质相似。“反萃取”后,镓的存在形式为
(4)GaN可采用“MOCVD(金属有机物化学气相淀积)技术”制得:以合成的三甲基镓[Ga(CH3)3]为原料,在一定条件下使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(5)下图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向

您最近一年使用:0次
2021-04-04更新
|
448次组卷
|
2卷引用:山西省太原市2021届高三年级3月模拟考试(一)理综化学试题



