1 . 电子表和电子计算器的电源通常用微型银—锌电池,其电极分别是 和
和 ,电解质溶液为
,电解质溶液为 溶液,总反应式为
溶液,总反应式为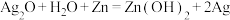 。下列说法
。下列说法不正确 的是
 和
和 ,电解质溶液为
,电解质溶液为 溶液,总反应式为
溶液,总反应式为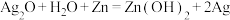 。下列说法
。下列说法A. 是正极, 是正极, 是负极 是负极 |
B.工作时,电池负极区溶液 减小 减小 |
C.工作时, 电极上反应式为 电极上反应式为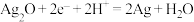 |
D.工作时,电子由 极经外电路流向 极经外电路流向 极 极 |
您最近半年使用:0次
2 . 物质发生化学反应时,常常伴随有能量变化。某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
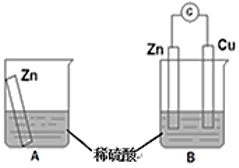
(1)A烧杯中反应的离子方程式为___________ 。
(2)B中Zn板是___________ 极,发生反应的电极反应式是___________ 。
(3)从能量转化的角度来看,A、B中反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为___________ ,B中是将化学能转变为___________ 。
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。

(1)A烧杯中反应的离子方程式为
(2)B中Zn板是
(3)从能量转化的角度来看,A、B中反应物的总能量
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。
| A.原电池反应的过程中一定有电子转移 |
| B.原电池装置需要2个电极 |
| C.电极一定都参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
您最近半年使用:0次
3 . 合成氨对人类生存具有重大意义:
(1)传统工业合成法:反应为N2(g)+3H2(g) 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
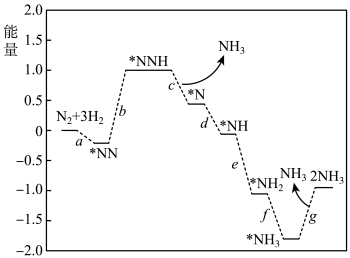
①N2的电子式是___ 。
②写出步骤b的化学方程式___ 。
③由图象可知合成氨反应的∆H__ 0(填“>”、“<”或“=”)。
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)___ 。
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是___ 。
②溶液中H+的移动方向是___ (填“向左”或“向右”)。
③下列说法正确的是___ 。
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
(1)传统工业合成法:反应为N2(g)+3H2(g)
 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
①N2的电子式是
②写出步骤b的化学方程式
③由图象可知合成氨反应的∆H
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是
②溶液中H+的移动方向是
③下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
您最近半年使用:0次
解题方法
4 . 原电池原理的发现是贮能和供能技术的巨大进步。图所示原电池的说法正确的是
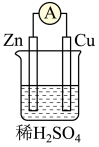

| A.电子经锌片流向铜片 |
| B.Cu为负极,Zn为正极 |
| C.该装置能将电能转化为化学能 |
| D.锌片上发生的反应为 2H++2e-=H2↑ |
您最近半年使用:0次



