1 . 1905年哈伯实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应: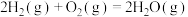 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为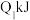 、
、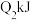 、
、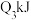 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为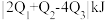 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: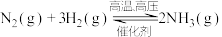 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
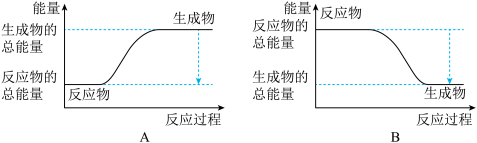
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为_______ kJ;下图能正确表示该反应中能量变化的是_________ (填“A”或“B”)。
(2)反应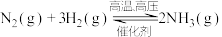 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上表数据回答:实验①②中,有一个实验使用了催化剂,它是实验_______ (填序号);实验③达平衡时NH3的转化率为_______ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_______ (填字母)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
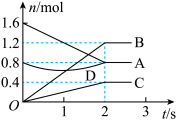
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为_______ ,②反应开始至2 s时,B的平均反应速率为_______ 。
(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术: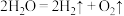 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:
①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为 ,则A极是电池的
,则A极是电池的_______ 极。
②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式_______ 。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应:
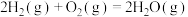 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为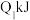 、
、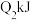 、
、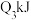 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为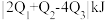 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: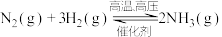 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
(2)反应
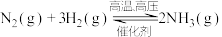 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.15 | 0.15 | 0.15 | 0.15 |
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为

(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术:
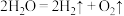 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为
 ,则A极是电池的
,则A极是电池的②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式
您最近半年使用:0次
名校
2 . 近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在2000C左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为:C2H5OH+3O2→2CO2+3H2O。下列说法不正确的是
| A.C2H5OH在电池的负极上参加反应 |
| B.在外电路中电子由负极沿导线流向正极 |
| C.1mol乙醇被氧化转移6mol电子 |
| D.电解质溶液中阳离子移向正极,阴离子移向负极 |
您最近半年使用:0次
2019-08-13更新
|
346次组卷
|
2卷引用:新疆维吾尔自治区克拉玛依市第十三中学2018-2019学年高一(实验班)下学期期中模拟考试化学试题
3 . 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
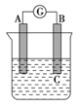

| A.A是Zn,B是Cu,C为稀硫酸 |
| B.A是Cu,B是Zn,C为稀硫酸 |
| C.A是Cu,B是Fe,C为硝酸铜溶液 |
| D.A是Fe,B是Ag,C为稀AgNO3溶液 |
您最近半年使用:0次
2017-07-21更新
|
3139次组卷
|
15卷引用:新疆克拉玛依市高级中学2021-2022学年高一下学期期末化学试题
新疆克拉玛依市高级中学2021-2022学年高一下学期期末化学试题黑龙江省哈尔滨市第六中学2016-2017学年高一下学期期末考试化学试题安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题《课时同步君》2017-2018学年高一化学人教必修2-2.2.1 化学能转化为电能【全国百强校】新疆兵团第二师华山中学2017-2018学年高一下学期期末考试化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高一下学期期中联考化学试题甘肃省临夏中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市第六中学2018-2019学年高一下学期期末考试化学试题湖南省株洲市2019-2020学年高一上学期期中考试化学试题黑龙江省七台河市第一中学2019-2020学年高一下学期期末考试化学试题广西壮族自治区防城港市防城中学2019-2020学年高一下学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2020-2021学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高一下学期期末考试化学试卷安徽省滁州市定远县育才学校2021-2022学年高二(普通班)下学期开学摸底考试化学试题广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题



