名校
解题方法
1 . 我国科学家设计可同时实现, 制备和海水淡化的新型电池,装置意图如图,下列说法
制备和海水淡化的新型电池,装置意图如图,下列说法不正确 的是
 制备和海水淡化的新型电池,装置意图如图,下列说法
制备和海水淡化的新型电池,装置意图如图,下列说法
| A.电极a是正极 |
B.电极b的反应式: |
C.每生成 ,有 ,有 发生迁移 发生迁移 |
| D.离子交换膜c、d分别是阴离子交换膜和阳离子交换膜 |
您最近一年使用:0次
2023-12-11更新
|
366次组卷
|
2卷引用: 北京市第五中学2023-2024学年高二上学期12月月考化学试题
2 . 工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
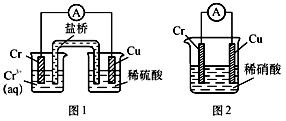

| A.图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中 |
| B.由实验现象可知:金属活动性Cu>Cr |
| C.图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+ |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
您最近一年使用:0次
2018-04-10更新
|
241次组卷
|
2卷引用:重庆市第一中学2017-2018学年高二下学期第一次月考化学试题
名校
3 . 我国科研人员设计将脱除SO2的反应与制备H2O2相结合的协同转化装置如图。在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。已知:
①单独制备H2O2:2H2O+O2=2H2O2,不能自发进行;
②单独脱除SO2:4OH-+2SO2+O2=2SO +2H2O,能自发进行。
+2H2O,能自发进行。
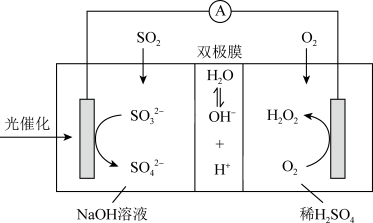
下列说法不正确的是
①单独制备H2O2:2H2O+O2=2H2O2,不能自发进行;
②单独脱除SO2:4OH-+2SO2+O2=2SO
 +2H2O,能自发进行。
+2H2O,能自发进行。
下列说法不正确的是
| A.单独脱除SO2的反应为吸热反应 |
| B.反应过程中不需补加稀H2SO4 |
| C.正极的电极反应式:O2+2e-+2H+=H2O2 |
| D.协同转化总反应:SO2+O2+2H2O=H2O2+H2SO4 |
您最近一年使用:0次
名校
4 . 电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:
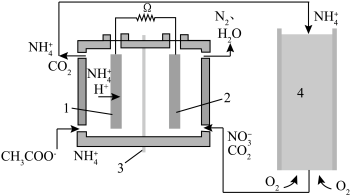
(1)电极2名称:___________ 极,电池工作一段时间后,电极2附近的pH___________ (填“增大”“减小”或“不变”)。
(2)在好氧微生物反应器中发生的反应方程式___________ 。
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为___________ mol。
II.次磷酸钴(II)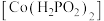 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
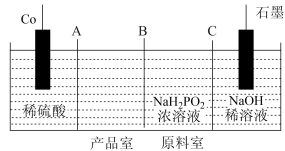
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是___________ 。
(5)石墨电极每生成1molH2时,___________ 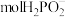 向
向___________ 迁移(填“阴极室”“阳极室”或“产品室”)。
(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为___________ 。
(7)用 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为___________ 。
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:

(1)电极2名称:
(2)在好氧微生物反应器中发生的反应方程式
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为
II.次磷酸钴(II)
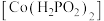 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是
(5)石墨电极每生成1molH2时,
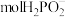 向
向(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为
(7)用
 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用电化学法制备,装置如图1所示,含Fe的催化电极反应机理如图2所示,不考虑溶液体积的变化。
下列说法正确的是
下列说法正确的是

| A.电池工作时,Pt电极为正极 |
| B.图2中,M为H+,N为NH3OH+ |
| C.电池工作时,每消耗2.24LNO左室溶液质量增加3.3g |
| D.电池工作一段时间后,正极区溶液的pH减小 |
您最近一年使用:0次
2024-01-16更新
|
184次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
名校
解题方法
6 . “双碳(即碳达峰与碳中和)”要求加快降低碳排放步伐,引导绿色技术创新,提高产业和经济的全球竞争力。电催化 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:
(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。 的移动方向是
的移动方向是___________ (填“向左移动”或“向右移动”)。
②图2中,生成甲醇的电极为___________ (填“阳极”或“阴极”),其电极反应式为___________ 。
③若图2中的“直流电源”用图1装置代替,则电极A连接___________ (填“C”或“D”)极。
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。___________ (填“p”或“q”)。
②电解总过程的化学方程式为___________ 。
③该电化学反应机理中,充当氧化剂的物质有___________ (填一种,填化学式或结构简式)。
(3)通过阴离子交换膜及合适的催化剂,先使 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:___________ (填“阴”或“阳”)极产物。
②电极H上生成67.2L(标准状况) 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到___________ g环氧乙烷。
 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用
 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。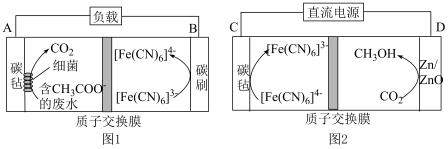
 的移动方向是
的移动方向是②图2中,生成甲醇的电极为
③若图2中的“直流电源”用图1装置代替,则电极A连接
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以
 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。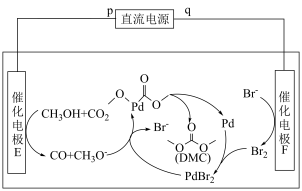
②电解总过程的化学方程式为
③该电化学反应机理中,充当氧化剂的物质有
(3)通过阴离子交换膜及合适的催化剂,先使
 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示: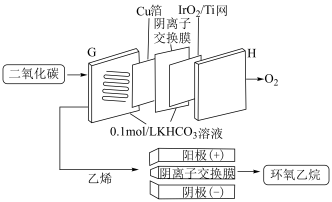
②电极H上生成67.2L(标准状况)
 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到
您最近一年使用:0次
2024-01-07更新
|
108次组卷
|
2卷引用:河南省驻马店市遂平县第一高级中学2023-2024学年高二上学期期中考试化学试卷
解题方法
7 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如图。不考虑溶液体积的变化,下列说法正确的是
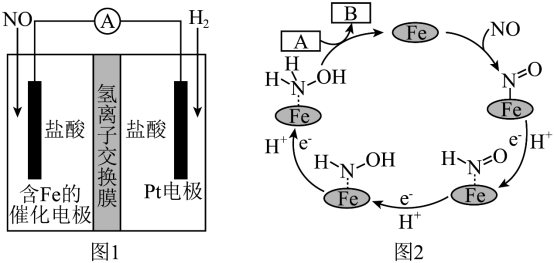

| A.电池工作时,含Fe的催化电极为正极,发生还原反应 |
B.图2中,A为H+和e-,B为 |
| C.电池工作时,每消耗标况下2.24LNO,左室溶液质量增加3.0g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次
名校
解题方法
8 . 目前,我国光伏发电并网装机容量稳居全球首位。以四甲基氯化铵[(CH3)4NCl]为原料,采用光伏并网发电装置,通过电渗析法合成(CH3)4NOH,工作原理如图。下列说法正确的是
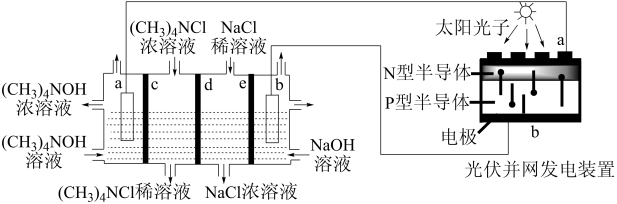
| A.光伏并网发电装置中N型半导体为负极 |
| B.c为阳离子交换膜,d、e均为阴离子交换膜 |
| C.保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 |
| D.制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况) |
您最近一年使用:0次
2023-12-19更新
|
224次组卷
|
2卷引用:山东省实验中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
9 . 化学性质类似NH4Cl的盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂。工业上主要采用图1所示的方法制备,其电池装置中含Fe的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有Cl-、 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
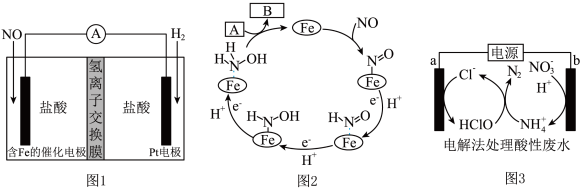
 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
| A.图1为原电池,含Fe的催化电极为负极 |
| B.图1电池工作时,每消耗3.36LH2(标准状况下),左室溶液质量增加3.3g |
| C.图2中A为H+和e-,B为NH3OH+ |
D.图3中处理 ,酸性废水中Cl-减少5mol ,酸性废水中Cl-减少5mol |
您最近一年使用:0次
2023-10-11更新
|
324次组卷
|
4卷引用:山东省青岛第二中学2023-2024学年高二上学期10月月考化学试题
10 . 工业电解食盐水制备烧碱的装置如图所示(PR电极均为惰性电极),下列说法错误的是
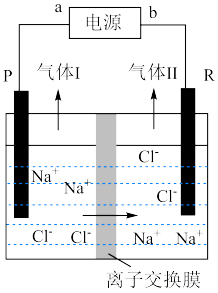

| A.该离子交换膜为阳离子交换膜 | B.b为电源的正极 |
| C.气体Ⅰ为Cl2 | D.R电极上发生还原反应 |
您最近一年使用:0次
2023-10-03更新
|
128次组卷
|
2卷引用:辽宁省抚顺市六校协作体2022-2023学年高二上学期期中考试化学试题



