1 . (一)己二腈(NC(CH2)4CN)是一种重要的化工产品,工业上先以丙烯为原料制备丙烯腈(CH2=CHCN),再用丙烯腈电合成己二腈,总反应式为CH2=CHCN+2H2O=2NC(CH2)4CN+O2↑。(已知丙烯腈难溶于水,易溶于有机溶剂)。如图为模拟工业电合成己二腈装置图,回答下列问题:

(1)碳棒电极为__ 极(填“阴”或“阳”),其电极反应方程式为__ 。
(2)在甲室中加入异丙醇的作用是__ 。
(3)在甲室中得到产品己二腈54g时,乙室中质量减轻___ g。
(二)2019年诺贝尔化学奖颁给了三个人,其中一个是Goodenough(古迪纳夫),他因为发明可充电锂离子电池而闻名于世,他建造了锂离子电池的神经系统,被业界称为“锂电池之父”。其中一款是钴酸锂(LiCoO2)电池,它的工作原理如图所示,图中电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2 C6+LiCoO2。
C6+LiCoO2。
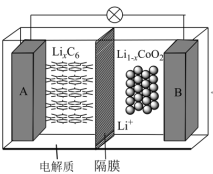
(4)放电时A电极为__ (填“正”或“负”)极,该电极的电极方程式为__ 。
(5)若该锂离子电池充电时,B电极的电极反应方程式为__ 。
(6)若用该锂离子电池给铁片上镀铜,铜片应连接该锂离子电池的极__ (填“A”或“B”),维持电流强度为1A,电池工作二十分钟,理论消耗Cu__ g(已知F=96500C•mol-1,保留两位有效数字)。

(1)碳棒电极为
(2)在甲室中加入异丙醇的作用是
(3)在甲室中得到产品己二腈54g时,乙室中质量减轻
(二)2019年诺贝尔化学奖颁给了三个人,其中一个是Goodenough(古迪纳夫),他因为发明可充电锂离子电池而闻名于世,他建造了锂离子电池的神经系统,被业界称为“锂电池之父”。其中一款是钴酸锂(LiCoO2)电池,它的工作原理如图所示,图中电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2
 C6+LiCoO2。
C6+LiCoO2。
(4)放电时A电极为
(5)若该锂离子电池充电时,B电极的电极反应方程式为
(6)若用该锂离子电池给铁片上镀铜,铜片应连接该锂离子电池的极
您最近一年使用:0次
名校
解题方法
2 . 一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。回答下列问题:
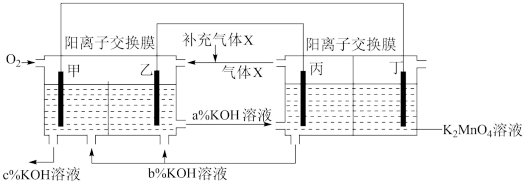
(1)甲为电源的___ 极。
(2)乙极的电极反应式为___ ,丁极的电极反应式为___ 。
(3)KOH溶液的质量分数,将a%、b%、c%由大到小排序___ 。
(4)标准状况下,甲电极上每消耗22.4L气体时,理论上阳极区减轻质量__ g,阴极区产生___ molOH-。

(1)甲为电源的
(2)乙极的电极反应式为
(3)KOH溶液的质量分数,将a%、b%、c%由大到小排序
(4)标准状况下,甲电极上每消耗22.4L气体时,理论上阳极区减轻质量
您最近一年使用:0次
名校
3 . 回答下列问题:
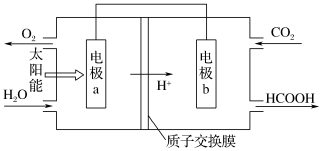
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作___________ 极,发生的电极反应式为___________ 。
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为___________ 极,Y电极反应式为___________ 。
②Y极生成1 mol Cl2时,___________ mol Li+移向X极。
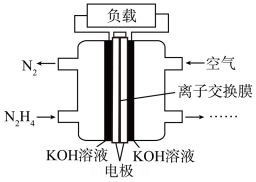
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH溶液作电解质溶液。负极反应式为___________ ,正极反应式为___________ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为
②Y极生成1 mol Cl2时,
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH溶液作电解质溶液。负极反应式为

您最近一年使用:0次
名校
解题方法
4 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是
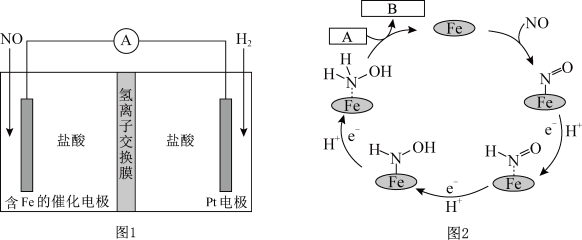

| A.电池工作时,Pt电极是正极 |
| B.图2中,A为H+和e-,B为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次
2022-04-20更新
|
2127次组卷
|
14卷引用:江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题
江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题福建省厦门第一中学2023-2024学年高二上学期10月月考试化学试题福建省福州市2022届高中毕业班(3月)第二次质量检测化学试题湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)河北省石家庄市第二中学2022届高三下学期5月模拟考试化学试题江苏省南京市第十三中学2022届高三下学期适应性考试化学试题湖南省郴州市2023届高三下学期第三次教学质量监测化学试题江苏省镇江中学2022-2023学年高一下学期期中考试化学试题湖南省常德市第一中学2022-2023学年高三下学期5月月考化学试题江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题福建省漳州第一中学2023届高三下学期毕业班质检考化学试题福建省南平第一中学2023-2024学年高三上学期第二次阶段考化学试题江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试题
20-21高二上·江苏镇江·阶段练习
5 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
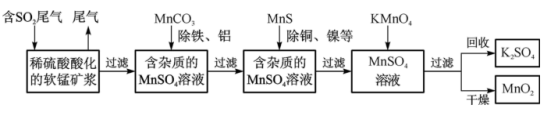
请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。请画出该反应的能量变化示意图___________ 。

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。
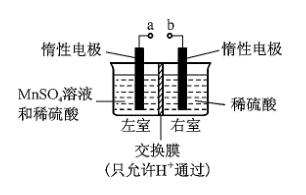
①a应与直流电源的___________ (填“正”或“负”)极相连。
②电解过程中氢离子的作用是___________ ;若转移的电子数为6.02×1023,左室溶液中最终n(H+)的变化量为___________ 。
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是___________ 。
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。
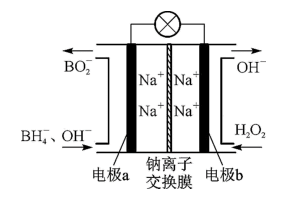
则该电池放电时通入H2O2的一极为___________ 极,电极反应式为___________ ;通入NaBH4的一极电极反应式为___________ 。

请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。

①a应与直流电源的
②电解过程中氢离子的作用是
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。

则该电池放电时通入H2O2的一极为
您最近一年使用:0次
6 . 以某锂离子电池、丙烯腈电合成己二腈[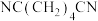 ]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是
]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是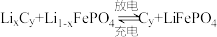 。
。
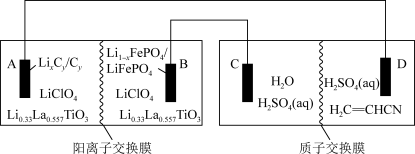
当锂离子电池放电时,回答下列问题:
(1)A极上发生的反应是_______ (填“氧化反应”或“还原反应”), 迁移方向是
迁移方向是______ (指明由阳离子交换膜哪一侧迁移到哪一侧)。
(2)B极的电极反应式为_______ 。
(3)C极上产生的气体是_______ (填化学式),D极的电极反应式为_______ 。
(4)稀硫酸的作用是_______ 。
(5)A极质量减轻14g,理论上可制备________ mol己二腈。
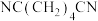 ]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是
]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是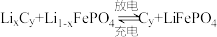 。
。
当锂离子电池放电时,回答下列问题:
(1)A极上发生的反应是
 迁移方向是
迁移方向是(2)B极的电极反应式为
(3)C极上产生的气体是
(4)稀硫酸的作用是
(5)A极质量减轻14g,理论上可制备
您最近一年使用:0次
名校
解题方法
7 . 有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是
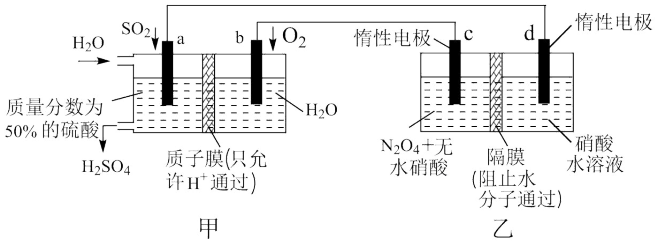

| A.图中的甲池为电解池,乙池为原电池 |
| B.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O=N2O5+2H+ |
C.a极发生的电极反应为SO2-2e-+2H2O= +4H+ +4H+ |
| D.每转移2mol电子,生成1molN2O5和1molH2SO4 |
您最近一年使用:0次
2022-02-13更新
|
1222次组卷
|
3卷引用:河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题
名校
解题方法
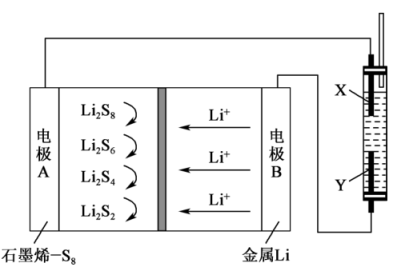
8 . 用石墨烯锂硫电池电解制备 的装置如图所示。电池放电时的反应为
的装置如图所示。电池放电时的反应为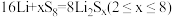 ,电解池两极材料分别为
,电解池两极材料分别为 和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
 的装置如图所示。电池放电时的反应为
的装置如图所示。电池放电时的反应为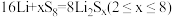 ,电解池两极材料分别为
,电解池两极材料分别为 和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
| A.Y是铁电极,发生氧化反应 |
B.电子流动的方向: |
C.正极可发生反应: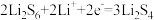 |
D.锂电极减重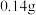 时,则电路中转移 时,则电路中转移 电子 电子 |
您最近一年使用:0次
2021-12-30更新
|
429次组卷
|
3卷引用:山西省运城市教育发展联盟2021-2022学年高二上学期12月月考化学试题
9 . 某学习小组设想利用A装置电解制备绿色硝化剂 ,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态
,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态 中发生微弱电离。
中发生微弱电离。
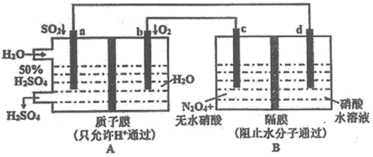
请回答:
(1)a电极名称为_______ 。
(2)写出B装置中生成 的电极反应式
的电极反应式_______ 。
(3) 与水反应生成
与水反应生成 ,
, 作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下)
作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下) 与
与 的混合物,则该硝酸物质的量浓度为
的混合物,则该硝酸物质的量浓度为___ 。
 ,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态
,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态 中发生微弱电离。
中发生微弱电离。
请回答:
(1)a电极名称为
(2)写出B装置中生成
 的电极反应式
的电极反应式(3)
 与水反应生成
与水反应生成 ,
, 作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下)
作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下) 与
与 的混合物,则该硝酸物质的量浓度为
的混合物,则该硝酸物质的量浓度为
您最近一年使用:0次
名校
10 . 目前研究比较热门的Al—H2O2电池,其电池总反应为2Al+3HO =2Al
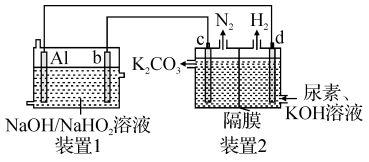
=2Al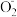 +OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
 =2Al
=2Al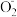 +OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
| A.Al为负极,c为阴极 |
| B.装置1中OH-移向电极b |
C.电极c的电极反应式为CO(NH2)2-6e-+8OH-=CO +N2+6H2O +N2+6H2O |
| D.通电一段时间后,若Al电极的质量减轻5.4g,则d电极产生H26.72L |
您最近一年使用:0次
2021-09-11更新
|
866次组卷
|
4卷引用:湖北省阳新高中2021-2022学年高二上学期9月月考化学试题
湖北省阳新高中2021-2022学年高二上学期9月月考化学试题湖北省新高考联考协作体2021-2022学年高三上学期起点考试化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点湖北省枣阳市第一中学2022-2023学年高三上学期9月月考化学试题



