名校
解题方法
1 . “双碳(即碳达峰与碳中和)”要求加快降低碳排放步伐,引导绿色技术创新,提高产业和经济的全球竞争力。电催化 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:
(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
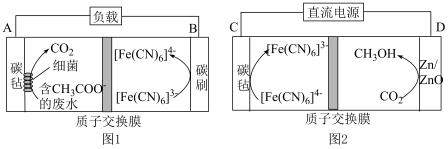
①图1中, 的移动方向是
的移动方向是___________ (填“向左移动”或“向右移动”)。
②图2中,生成甲醇的电极为___________ (填“阳极”或“阴极”),其电极反应式为___________ 。
③若图2中的“直流电源”用图1装置代替,则电极A连接___________ (填“C”或“D”)极。
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。
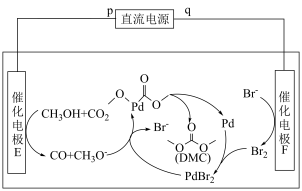
①直流电源的正极为___________ (填“p”或“q”)。
②电解总过程的化学方程式为___________ 。
③该电化学反应机理中,充当氧化剂的物质有___________ (填一种,填化学式或结构简式)。
(3)通过阴离子交换膜及合适的催化剂,先使 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
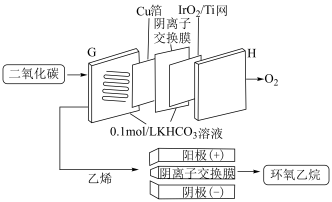
①环氧乙烷是氯碱电化学体系的___________ (填“阴”或“阳”)极产物。
②电极H上生成67.2L(标准状况) 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到___________ g环氧乙烷。
 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用
 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
①图1中,
 的移动方向是
的移动方向是②图2中,生成甲醇的电极为
③若图2中的“直流电源”用图1装置代替,则电极A连接
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以
 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。
①直流电源的正极为
②电解总过程的化学方程式为
③该电化学反应机理中,充当氧化剂的物质有
(3)通过阴离子交换膜及合适的催化剂,先使
 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
①环氧乙烷是氯碱电化学体系的
②电极H上生成67.2L(标准状况)
 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到
您最近一年使用:0次
名校
解题方法
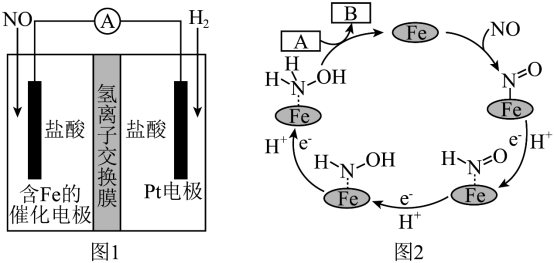
2 . 目前,我国光伏发电并网装机容量稳居全球首位。以四甲基氯化铵[(CH3)4NCl]为原料,采用光伏并网发电装置,通过电渗析法合成(CH3)4NOH,工作原理如图。下列说法正确的是
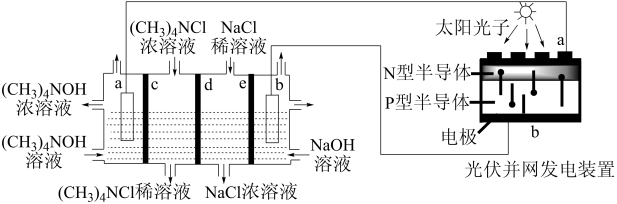

| A.光伏并网发电装置中N型半导体为负极 |
B.c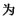 阳离子交换膜,d、e均为阴离子交换膜 阳离子交换膜,d、e均为阴离子交换膜 |
| C.保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 |
| D.制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况) |
您最近一年使用:0次
3 . 盐酸羟胺(化学式为NH3OHCl,其中N为 价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
 价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
| A.含Fe的催化电极为正极 |
| B.图2中,A为H+,B为NH3OH+ |
| C.电池工作时,每消耗2.24L NO(标准状况下),左室溶液质量增加3.0g |
| D.电池工作时,H+从右室穿过氢离子交换膜向左室迁移 |
您最近一年使用:0次
解题方法
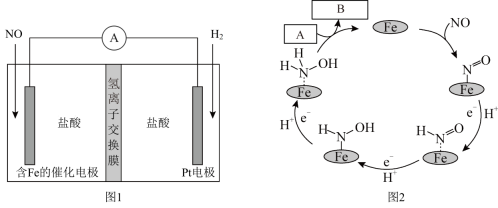
4 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如图。不考虑溶液体积的变化,下列说法正确的是

| A.电池工作时,含Fe的催化电极为正极,发生还原反应 |
B.图2中,A为H+和e-,B为 |
| C.电池工作时,每消耗标况下2.24LNO,左室溶液质量增加3.0g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次
名校
解题方法
5 . 根据下列要求回答问题。
(1)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应方程式为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入”CO2,其工作原理如图所示。
2Na2CO3+C.放电时该电池“吸入”CO2,其工作原理如图所示。
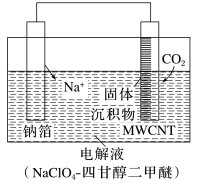
①放电时,正极的电极反应式为___________ 。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28 g时,转移电子的物质的量为___________ 。
③可选用高氯酸钠-四甘醇二甲醚作电解液的理由是___________ 。
(2)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
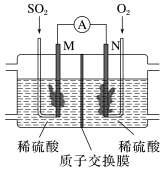
①M极发生的电极反应式为___________ 。
②质子交换膜右侧的溶液在反应后pH___________ (填“增大”“减小”或“不变”)。
③当外电路通过0.2 mol e-时,质子交换膜左侧的溶液质量___________ (填“增大”或“减小”)___________ g。
(1)我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应方程式为4Na+3CO2
 2Na2CO3+C.放电时该电池“吸入”CO2,其工作原理如图所示。
2Na2CO3+C.放电时该电池“吸入”CO2,其工作原理如图所示。
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28 g时,转移电子的物质的量为
③可选用高氯酸钠-四甘醇二甲醚作电解液的理由是
(2)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。

①M极发生的电极反应式为
②质子交换膜右侧的溶液在反应后pH
③当外电路通过0.2 mol e-时,质子交换膜左侧的溶液质量
您最近一年使用:0次
名校
解题方法
6 . 化学性质类似NH4Cl的盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂。工业上主要采用图1所示的方法制备,其电池装置中含Fe的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有Cl-、 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
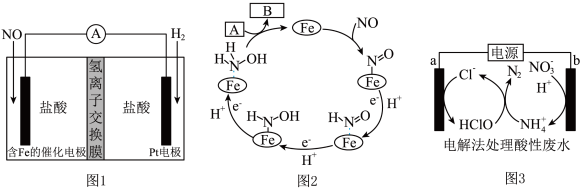
 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
| A.图1为原电池,含Fe的催化电极为负极 |
| B.图1电池工作时,每消耗3.36LH2(标准状况下),左室溶液质量增加3.3g |
| C.图2中A为H+和e-,B为NH3OH+ |
D.图3中处理 ,酸性废水中Cl-减少5mol ,酸性废水中Cl-减少5mol |
您最近一年使用:0次
2023-10-11更新
|
307次组卷
|
4卷引用:山东省青岛第二中学2023-2024学年高二上学期10月月考化学试题
名校
7 . 电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:
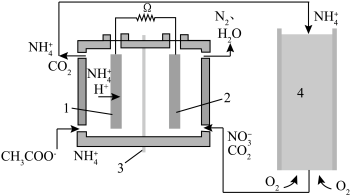
(1)电极2名称:___________ 极,电池工作一段时间后,电极2附近的pH___________ (填“增大”“减小”或“不变”)。
(2)在好氧微生物反应器中发生的反应方程式___________ 。
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为___________ mol。
II.次磷酸钴(II)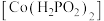 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
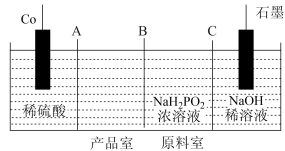
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是___________ 。
(5)石墨电极每生成1molH2时,___________ 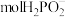 向
向___________ 迁移(填“阴极室”“阳极室”或“产品室”)。
(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为___________ 。
(7)用 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为___________ 。
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:

(1)电极2名称:
(2)在好氧微生物反应器中发生的反应方程式
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为
II.次磷酸钴(II)
 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是
(5)石墨电极每生成1molH2时,
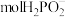 向
向(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为
(7)用
 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
8 . 无水氯化铝是有机化工中常用的催化剂,178℃时升华,极易潮解。某化学兴趣小组设计了下列实验。根据所学知识,回答下列问题:
【实验1】利用置换反应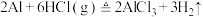 制备少量无水氯化铝,实验装置如图。
制备少量无水氯化铝,实验装置如图。
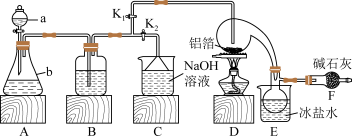
(1)a中盛放浓硫酸,b中盛放浓盐酸。将a中液体逐滴加入b中。B装置中的试剂为_______ 。
(2)实验时,检验装置气密性后,向D装置的曲颈瓶中加入铝箔,连接好装置,接下来对 、
、 进行的操作是
进行的操作是_______ ,然后加热D装置。
(3)F中干燥管内碱石灰的作用是_______ 。
【实验2】利用原电池反应检测金属的活动性顺序,甲、乙两组均使用镁片和铝片作电极,但甲组将电极放入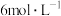 的硫酸中,乙组将电极放入
的硫酸中,乙组将电极放入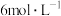 的氢氧化钠溶液中,装置如图所示。
的氢氧化钠溶液中,装置如图所示。
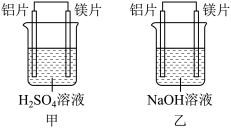
(4)写出甲电池中正极的电极反应式:_______ 。在标准状况下,正极产生 气体,得
气体,得_______ mol电子。
(5)乙电池中负极为_______ ,总反应的离子方程式为_______ 。
(6)由此实验,可得到的正确结论有_______(填标号)。
【实验1】利用置换反应
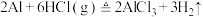 制备少量无水氯化铝,实验装置如图。
制备少量无水氯化铝,实验装置如图。
(1)a中盛放浓硫酸,b中盛放浓盐酸。将a中液体逐滴加入b中。B装置中的试剂为
(2)实验时,检验装置气密性后,向D装置的曲颈瓶中加入铝箔,连接好装置,接下来对
 、
、 进行的操作是
进行的操作是(3)F中干燥管内碱石灰的作用是
【实验2】利用原电池反应检测金属的活动性顺序,甲、乙两组均使用镁片和铝片作电极,但甲组将电极放入
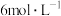 的硫酸中,乙组将电极放入
的硫酸中,乙组将电极放入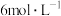 的氢氧化钠溶液中,装置如图所示。
的氢氧化钠溶液中,装置如图所示。
(4)写出甲电池中正极的电极反应式:
 气体,得
气体,得(5)乙电池中负极为
(6)由此实验,可得到的正确结论有_______(填标号)。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属活动性不一定比铝的强 |
| C.该实验说明金属活动性顺序表已过时,已没有利用价值 |
| D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析 |
您最近一年使用:0次
名校
9 . 铁是人类最早使用的金属,它在日常生活中的应用十分广泛。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是______________ 。
②正极的电极反应式是_________________________________ 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低。其原因是_____________________________ 。

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_______ 。能表示其原理的正极反应式为________________________ 。
(2)大试管中发生的反应方程式为______________________________________ 。
(3)仪器A的名称为_______________ ,其中装的药品可以是_______________ 。
(4)有实验可知,决定铁生锈快慢的一个重要因素是___________________ 。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 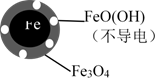 |  |
pH=4.5时,NO3-的去除率低。其原因是

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于
(2)大试管中发生的反应方程式为
(3)仪器A的名称为
(4)有实验可知,决定铁生锈快慢的一个重要因素是
您最近一年使用:0次
10 . 工业电解食盐水制备烧碱的装置如图所示(PR电极均为惰性电极),下列说法错误的是
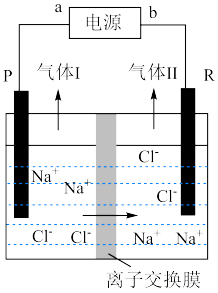

| A.该离子交换膜为阳离子交换膜 | B.b为电源的正极 |
| C.气体Ⅰ为Cl2 | D.R电极上发生还原反应 |
您最近一年使用:0次
2023-10-03更新
|
112次组卷
|
2卷引用:辽宁省抚顺市六校协作体2022-2023学年高二上学期期中考试化学试题



