名校
解题方法
1 . 化学反应与能量变化是化学研究的重要问题,根据相关材料分析回答:
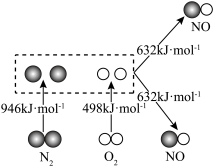
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示,则图中三种分子最稳定的是_________ 。
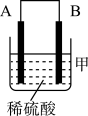
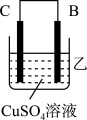
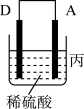
(3)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是_______ ;写出装置乙中正极的电极反应式:_______ 。
(4)一种熔融碳酸盐燃料电池原理示意如图所示。电池工作时,外电路上电流的方向应从电极___________ (填A或B)流向用电器。内电路中, 向电极
向电极___________ (填A或B)移动,电极A上CO参与的电极反应为___________ 。
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示,则图中三种分子最稳定的是
| A.CH4+2O2=CO2+2H2O | B.Fe+CuSO4=FeSO4+Cu |
| C.2NaOH+H2SO4=Na2SO4+2H2O | D.Pb+PbO2+2H2SO4=2PbSO4+2H2O |
| 装置 |
|
|
|
| 电子从A到B | C电极的质量增加 | 二价金属D不断溶解 |
(4)一种熔融碳酸盐燃料电池原理示意如图所示。电池工作时,外电路上电流的方向应从电极
 向电极
向电极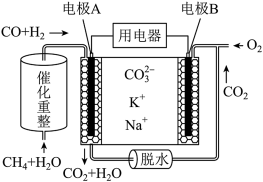
您最近一年使用:0次
2023-09-08更新
|
759次组卷
|
2卷引用:内蒙古自治区通辽市第一中学2023-2024学年高一下学期4月月考化学试题
解题方法
2 . 氢气是未来最理想的能源;科学家最近研制出利用太阳能产生激光,并在二氧化光钛( )表面作用使海水分解得到复气的新技术:
)表面作用使海水分解得到复气的新技术: 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,_______ 能转变为_______ 能,二氧化钛作_______ 。水分解时,断裂的化学键为_______ 键,分解海水的反应属于_______ 反应(填“放热”或“吸热”)。
(2)火箭推进器中盛有强还原剂液态肼( )和强氧化剂液态双氧水。当它们混合反应时,即产生大量氯气和水蒸气,并放出大量热。已知1.6g液态肼在上述反应中放出64.22kJ的热量。
)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氯气和水蒸气,并放出大量热。已知1.6g液态肼在上述反应中放出64.22kJ的热量。
①反应的热化学方程式为_______ 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_______ 。
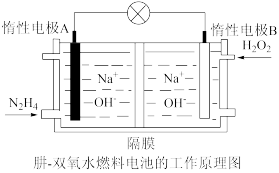
(3)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池负极反应式为_______ 。
 )表面作用使海水分解得到复气的新技术:
)表面作用使海水分解得到复气的新技术: 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:(1)分解海水时,
(2)火箭推进器中盛有强还原剂液态肼(
 )和强氧化剂液态双氧水。当它们混合反应时,即产生大量氯气和水蒸气,并放出大量热。已知1.6g液态肼在上述反应中放出64.22kJ的热量。
)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氯气和水蒸气,并放出大量热。已知1.6g液态肼在上述反应中放出64.22kJ的热量。①反应的热化学方程式为
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(3)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池负极反应式为

您最近一年使用:0次
名校
解题方法
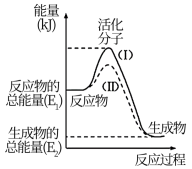
3 . Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。
(1)下列变化中满足如图图示的是___________ (填选项字母);
A.镁和稀盐酸的反应B. 与
与 的反应
的反应
C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ (填选项字母);
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3) 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生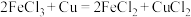 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为___________ g;
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:___________ ,
②电池工作一段时间后硫酸溶液的pH___________ (填“增大”“减小”或“不变”)
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。
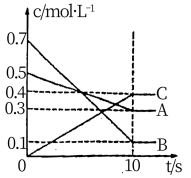
①该反应的化学方程式为___________ ,
②10s内用B表示的反应速率为___________ 。
 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。(1)下列变化中满足如图图示的是

A.镁和稀盐酸的反应B.
 与
与 的反应
的反应C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3)
 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生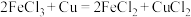 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:
②电池工作一段时间后硫酸溶液的pH
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。

①该反应的化学方程式为
②10s内用B表示的反应速率为
您最近一年使用:0次
2021-07-22更新
|
747次组卷
|
2卷引用:内蒙古赤峰市2020-2021学年高二下学期期末考试化学(B)试题。
4 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol−1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol−1
C(s)+ O2(g)=CO(g)ΔH=-111kJ·mol−1
O2(g)=CO(g)ΔH=-111kJ·mol−1
该催化重整反应的ΔH=________ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________________________ 。
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是________ ,负极反应式是_____________________________ 。
(3)正极现象是_______________________________________________ 。
(4)放电时OH-向_____________ (填“正极”或“负极”)移动。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol−1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol−1
C(s)+
 O2(g)=CO(g)ΔH=-111kJ·mol−1
O2(g)=CO(g)ΔH=-111kJ·mol−1该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是
(3)正极现象是
(4)放电时OH-向
您最近一年使用:0次