名校
解题方法
1 . 我国科学家设计了一种利用废水中的 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
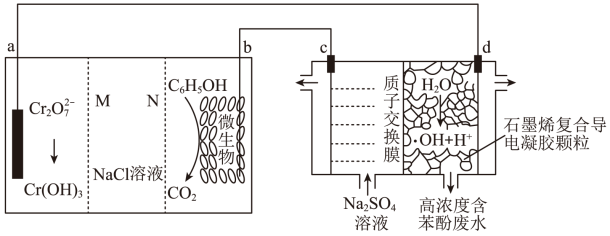
 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
| A.电子转移方向:c电极→导线→b电极 |
B.d电极的电极反应为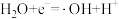 |
C.右侧装置中,c、d两电极产生气体的体积比(相同条件下)为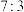 |
D.若a电极上有 参与反应,理论上 参与反应,理论上 溶液中有 溶液中有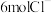 通过阴离子膜进入a电极区溶液 通过阴离子膜进入a电极区溶液 |
您最近一年使用:0次
2023-05-04更新
|
299次组卷
|
2卷引用:河北省石家庄部分重点高中2022-2023学年高三下学期3月月考化学试题
名校
2 . 电池的应用给我们的生活带来了很多便利,请根据原电池工作原理回答下列问题:
(1)现有如下两个反应:①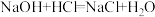 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是_______ (填序号)。该电池的正极材料是_______ 。
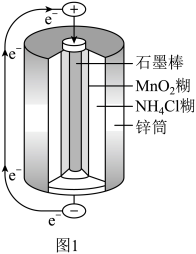
(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过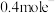 ,负极质量减少
,负极质量减少_______ g;工作时 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是_______ 。
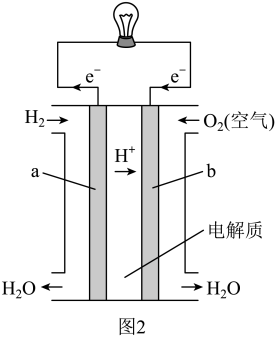
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式_______ 。若导线中通过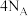 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为_______ (标况下)。
(4)直接乙醇燃料电池( )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
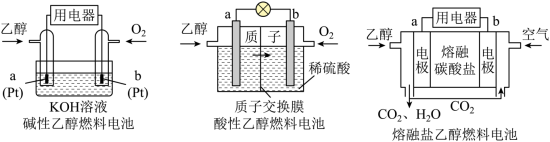
①碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
(1)现有如下两个反应:①
 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过
 ,负极质量减少
,负极质量减少 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式
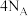 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为
(4)直接乙醇燃料电池(
 )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为
②酸性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为
您最近一年使用:0次
解题方法
3 . 能源、资源问题是当前人类社会面临的一项重大课题。直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。燃料电池将能量转化效率比直接燃烧效率高,H2、CH4、CH3OH都是重要的能源物质。
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
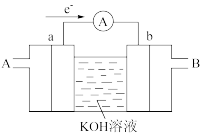
①使用时,空气从_____ 口通入(填“A”或“B”);负极是_____ (填“a”或“b”)。电流由_____ 流向_____ (填“a”或“b”)。其总反应方程式为_____ ,在碱性条件下,负极反应式为_____ 。
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:_____ 。
(2)某同学设计如图的原电池,负极实验现象为_____ ,则正极的电极反应式为:_____ ,当导线中有3.01×1023个电子流过,溶液质量变化为_____ g。

(3)能把硫酸铜溶液改成氢氧化钠溶液吗_____ (填“能”或“不能”),为什么_____ 。
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:
(2)某同学设计如图的原电池,负极实验现象为

(3)能把硫酸铜溶液改成氢氧化钠溶液吗
您最近一年使用:0次
名校
解题方法
4 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:
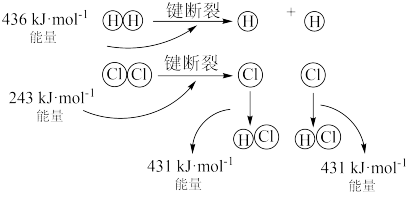
该反应为_______ (填“放热”或“吸热”)反应,其吸收或放出的热量为_______ 。
(2)下列变化中属于吸热反应的是_______ (填序号)。
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C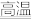 2CO
2CO
⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g)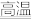 CO+ H2
CO+ H2
⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
若E1>E2,则该反应可用图_______ (填“A”或“B")表示。
Ⅱ.回答下列问题
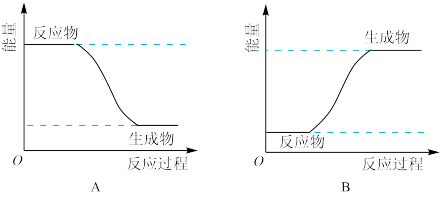
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是_______ (填装置序号),其正极的电极反应式为_______ ;若构建该原电池时两个电极的质量相等,当导线中通过0.4mol电子时,两个电极的质量差为_______ g。
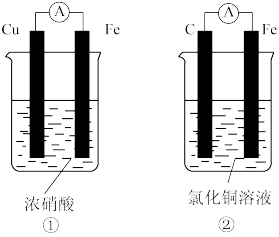
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则_______ (填“A”或“B”)处电极入口通CH4,其电极反应式为_______ 。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:

该反应为
(2)下列变化中属于吸热反应的是
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C
 2CO
2CO⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g)
 CO+ H2
CO+ H2⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。

若E1>E2,则该反应可用图
Ⅱ.回答下列问题
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是

将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则

您最近一年使用:0次
名校
解题方法
5 . 请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
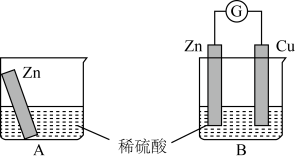
(1)B中Zn板是___________ 极,正极发生的电极反应是___________
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
(3)在B中,当导线中有1 mol电子通过时,理论上的两极变化是___________。
(4)若将反应2Fe3++Cu=Cu2++2Fe2+设计成原电池,写出正极电极反应式___________ ;
(5)写出碱性氢氧燃料电池正极电极反应式___________
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式___________
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:___________
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
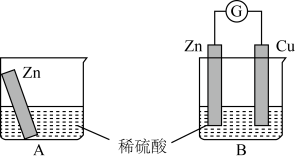
(1)B中Zn板是
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
| A.原电池反应的过程中一定有电子转移 |
| B.电极一定不能参加反应 |
| C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极 |
| D.氧化反应和还原反应可以拆开在两极发生 |
| A.锌片溶解32.5 g | B.锌片增重32.5 g |
| C.铜片上析出2 g H2 | D.铜片上析出1 mol H2 |
(5)写出碱性氢氧燃料电池正极电极反应式
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:
您最近一年使用:0次
名校
解题方法
6 . 为研究碘的化合物氧化性强弱设计如图实验,①、②实验左侧烧杯中溶液颜色都变蓝,下列说法中错误的是
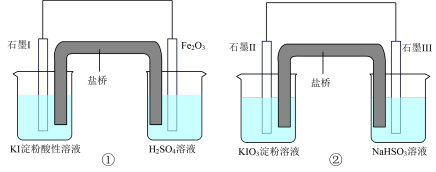

| A.①中Fe2O3极的电极反应式为Fe2O3+2e- + 6H+=2Fe2+ +3H2O |
| B.碘元素在装置①中被氧化,在装置②中被还原 |
| C.两装置的盐桥中阳离子都向含碘化合物烧杯中移动 |
| D.装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5 |
您最近一年使用:0次
2022-02-20更新
|
164次组卷
|
3卷引用:安徽省皖南地区2021-2022学年高二下学期开学调研考试化学试题
名校
解题方法
7 . 某实验小组同学进行如下实验:
(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__ (填序号)。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中__ (填A或B)处电极入口通甲烷,该原电池的正极电极反应式为___ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量__ mol。
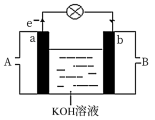
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
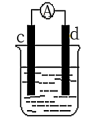
①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸,写出该原电池正极的电极反应式为___ 。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为__ ;该原电池的负极反应式为___ 。
(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中

(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸,写出该原电池正极的电极反应式为
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为
您最近一年使用:0次
解题方法
8 . 下列因果关系说法合理的是
| A.Mg的金属活动性强于Al,所以Mg、Al作电极的原电池中,Mg为负极,Al为正极 |
| B.浓硫酸能氧化Cu单质而稀硫酸不能,说明稀硫酸没有氧化性 |
| C.HCl的酸性强于H2S的,原因是Cl的非金属性强于S的 |
| D.过氧乙酸(CH3COOOH)与H2O2都包含“-O-O-”结构,所以两者均具有较强的氧化性 |
您最近一年使用:0次
解题方法
9 . 一种利用溶液浓差能驱动的原电池氧化含有甲醛的酸性有机废水的机理如图所示,装置中浓液和稀液的溶质均为NaCl,阴阳离子交换膜将浓液和稀液隔开,·OH具有很强的氧化性,甲醛最终转化为 ,下列说法正确的是
,下列说法正确的是
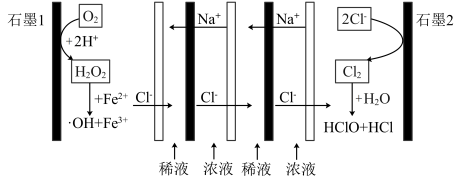
 ,下列说法正确的是
,下列说法正确的是
| A.石墨1为原电池的负极 |
B.正极区处理甲醛的化学方程式为 |
C.负极的电极反应式为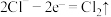 |
| D.若处理含1 mol HCHO的废水(其他物质不反应),电路中理论上转移2 mol电子 |
您最近一年使用:0次
2023-05-16更新
|
185次组卷
|
2卷引用:辽宁省抚顺市重点高中六校协作体2022-2023学年高二下学期期中考试化学试题
名校
解题方法
10 . 某研究性学习小组的同学对 、
、 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
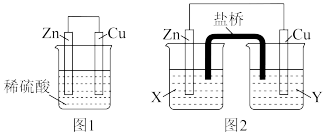
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为___________ 能。锌电极为___________ 极(填写“正”或“负”),电极反应为:___________
(2)图2中实验过程中只有Cu极上产生气泡,则X是_______ 溶液,正极上的电极反应式为_______ 。
(3)当图1装置中的溶液质量增加63g时,生成氢气_______ L(标准状况);当图2中锌电极的质量减少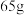 时,电路中转移的电子为
时,电路中转移的电子为_______  。
。
 、
、 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为
(2)图2中实验过程中只有Cu极上产生气泡,则X是
(3)当图1装置中的溶液质量增加63g时,生成氢气
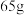 时,电路中转移的电子为
时,电路中转移的电子为 。
。
您最近一年使用:0次



