名校
1 . 下列叙述中正确的是
| A.原电池需要有两个活泼性不同的金属作电极 |
| B.钢铁发生腐蚀时,正极上发生的反应为Fe -2e- =Fe2+ |
| C.铜锌原电池工作时,若有13克锌被溶解,溶液中就有0.2mol电子通过 |
| D.由铜、锌作电极与硫酸溶液组成的原电池中,溶液中的H+向正极移动 |
您最近一年使用:0次
2019-06-22更新
|
262次组卷
|
4卷引用:河南省周口扶沟县高级中学2018-2019学年高一下学期期中考试化学试题
河南省周口扶沟县高级中学2018-2019学年高一下学期期中考试化学试题江苏省常州高级中学2018-2019学年高一下学期期中考试化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测河南省郑州市中牟县2020-2021学年高一下学期期中考试化学试题
名校
2 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
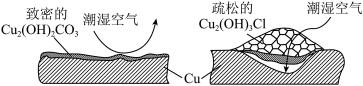
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
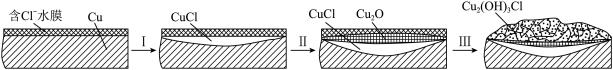
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
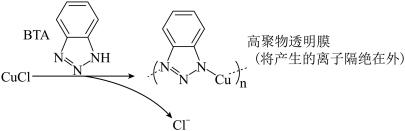
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2019-06-11更新
|
1882次组卷
|
7卷引用:中国人民大学附属中学2019届高三考前热身练习化学试题
3 . 关于如图所示装置的叙述错误的是
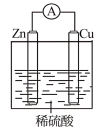

| A.锌是负极,其质量逐渐减小 |
| B.氢离子在铜表面得e- |
| C.电子从锌片经导线流向铜片 |
| D.电流从锌片经导线流向铜片 |
您最近一年使用:0次
2019-06-10更新
|
120次组卷
|
2卷引用:河南省鹤壁市淇滨高级中学2018-2019学年高一下学期第四次月考化学试题
名校
4 . 新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+ Li++ e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
| A.充电时电池反应为FePO4+Li++e-=LiFePO4 |
| B.放电时电池内部Li+向负极移动 |
| C.充电时动力电池的阳极应与外接电源的正极相连 |
| D.放电时,在正极上Li+得电子被还原 |
您最近一年使用:0次
2019-06-10更新
|
172次组卷
|
3卷引用:河南省长葛市第一高级中学2020-2021学年高二上学期阶段性测试试卷化学试题
真题
名校
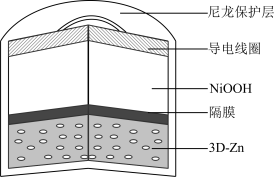
5 . 为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l) ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
 ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
| A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 |
| B.充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−=NiOOH(s)+H2O(l) |
| C.放电时负极反应为Zn(s)+2OH−(aq)−2e−=ZnO(s)+H2O(l) |
| D.放电过程中OH−通过隔膜从负极区移向正极区 |
您最近一年使用:0次
2019-06-09更新
|
20128次组卷
|
65卷引用:河南省郑州市第一中学2020届高三12月联考化学试题
河南省郑州市第一中学2020届高三12月联考化学试题2019年全国统一高考化学试题(新课标Ⅲ)(已下线)专题08 电化学及其应用——2019年高考真题和模拟题化学分项汇编辽宁省阜新市第二高级中学2018-2019学年高二下学期期末考试化学试题【全国百强校】四川省阆中中学2019-2020学年高二上学期开学考试化学试题四川阆中市德恒菁英外国语学校2019-2020学年高二上学期9月教学质量检测化学试题河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题黑龙江省鹤岗市第一中学2020届高三10月月考化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题江西省山江湖协作体2019-2020学年高二上学期第三次月考(自招班)化学试题江苏省无锡市普通高中2019-2020学年高三上学期期终调研试化学试题山西省临汾市2020届高三上学期第二次月考化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训四川省成都市树德中学2019-2020学年高二下学期期中考试化学试题2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.2 原电池 化学电源(讲)——2020年高考化学一轮复习讲练测(已下线)专题6.2 原电池 化学电源(练)——2020年高考化学一轮复习讲练测河北省鸡泽县第一中学2019-2020学年高一下学期开学考试化学试题(已下线)1.2.2 化学电源 练习《新教材同步备课》(鲁科版选择性必修1)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 高考帮(已下线)专题讲座(六)新型电源及电极反应式的书写(精讲)——2021年高考化学一轮复习讲练测(已下线)第20讲 原电池 化学电源(精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关江苏省镇江市吕叔湘中学2021届高三上学期11月教学调研化学试题(已下线)专题4.3.2 电解原理的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)小题必刷25 原电池及化学电源——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷26 电解池原理及其应用——2021年高考化学一轮复习小题必刷(通用版本)山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题山西省长治市第二中学校2020-2021学年高二上学期第二次月考化学试题吉林省长春市东北师范大学附属中学2019-2020学年高二上学期期末考试化学试题河南省济源市第五中学2020-2021学年高二下学期期末考试化学试题河北正定中学2020-2021学年高二上学期开学考试化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期7月月考化学试题河南省博爱县第一中学2023-2024学年高二上学期9月月考化学试题(已下线)高中化学苏教2019版必修第二册-专题6 第三单元综合拔高练(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)押全国卷理综第11题 电化学基础-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)辽宁省辽河油田第一高级中学2020-2021学年高一(A部)下学期期中考试化学试题(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第11题 电化学基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)回归教材重难点03 电化学-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题08电化学及其应用-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)第一节 原电池 第2课时 化学电源四川省德阳市广汉中学2022-2023学年高二上学期开学考试化学试题云南省罗平县第五中学2021-2022学年高二下学期6月月考化学试题江苏省无锡市江阴市2022-2023学年高三上学期阶段测试(期末)化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型108 新型电池电极反应式的书写(已下线)专题一 原电池的工作原理及其应用(已下线)专题12 电化学的综合应用(已下线)T13-电化学原理及应用北京市 首都师范大学附属中学2021-2022学年高二上学期期末考试化学试卷山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题云南省保山市腾冲市第八中学2021-2022学年高二上学期期末考试化学试题云南省保山市腾冲市第八中学2021-2022学年高二上学期期中考试化学试题
6 . 锌空气电池具有蓄电量大、充电循环次数多等优点(Zn与Al的化学性质相似)。下列有关说法错误的是( )
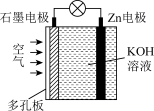

| A.电池放电时Zn电极逐渐溶解 | B.电池放电时化学能转化为电能 |
| C.电子由石墨经导线流向Zn片 | D.石墨为正极 |
您最近一年使用:0次
9-10高一下·河南郑州·阶段练习
名校
7 . 如图为某兴趣小组制作的番茄电池,下列说法正确的是
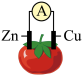

| A.电子由锌通过导线流向铜 |
| B.该装置将电能转化为化学能 |
| C.锌电极发生还原反应 |
| D.铜电极上无气泡产生 |
您最近一年使用:0次
2019-05-05更新
|
371次组卷
|
6卷引用:09-10年郑州盛同学校高一下学期阶段测试(二)化学卷
(已下线)09-10年郑州盛同学校高一下学期阶段测试(二)化学卷【全国百强校】贵州省铜仁市第一中学2018-2019学年高一下学期期中考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题广东省茂名地区2017-2018学年高二上学期期中考试化学(文)试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第二节 化学反应与能量转化(已下线)第2章 化学反应与能量(基础过关卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)
8 . 正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。
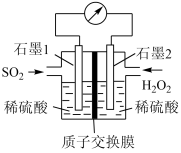
(1)石墨1为____ (填“正极”或“负极”),正极的电极反应式为______ 。
(2)反应的总方程式为_______ 。
(3)H+的迁移方向为由_____ 到____ 。(填“左”或“右”)
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为____ 。
(5)某同学关于原电池的笔记中,不合理的有____ 。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ ;某熔盐氢氧燃料电池的电解质是熔融的碳酸钾,则其负极反应为_____ 。
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为_____ 。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为
(2)反应的总方程式为
(3)H+的迁移方向为由
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
(5)某同学关于原电池的笔记中,不合理的有
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为
您最近一年使用:0次
2019-04-26更新
|
458次组卷
|
2卷引用:【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题
名校
9 . a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,电流由a经导线流向b,c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡,b、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
您最近一年使用:0次
2019-04-15更新
|
1669次组卷
|
20卷引用:河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题
河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题【全国百强校】江苏省海安高级中学2018-2019学年高一下学期3月月考化学试题2【市级联考】贵州省遵义市2018-2019学年高一下学期期中考试化学试题课时2 原电池的原理及应用——A学习区 夯实基础(鲁科版(2019)第二册)课时1 利用化学反应制备物质——A学习区 夯实基础(鲁科版必修2)山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第二节 化学反应与能量转化 方法帮山西省朔州市怀仁县大地学校2019-2020学年高一下学期期末考试化学试题湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题辽宁省锦州市义县高级中学2020-2021学年高二12月月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题山东省临朐县实验中学2020-2021学年高一下学期4月月考化学试题重庆市第七中学校2020-2021学年高一下学期半期考试化学试题重庆市四川外语学院重庆第二外国语学校2021-2022学年高一下学期期中考试化学试题广西钦州市第一中学2021-2022学年高二下学期期中考试理科综合化学试题北京市第五中学2021-2022学年高一下学期期中考试化学试题第一节 原电池 第1课时 原电池的工作原理四川省凉山州西昌市2021-2022学年高一下学期期中考试化学试题山东省文登第一中学2022-2023学年高二上学期1月期末考试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高一下学期4月月考化学试题
名校
10 . 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
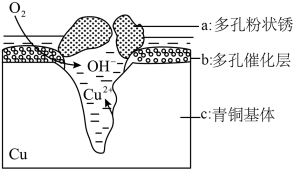

| A.腐蚀过程中,负极是c |
| B.正极反应是O2 + 4e-+2H2O=4OH- |
| C.若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为0.224L (相对原子质量Cu 64,Cl35.5) |
| D.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ |
您最近一年使用:0次
2019-04-15更新
|
245次组卷
|
7卷引用:2016-2017学年河南省南阳市新野高级中学高二上第二次月考化学卷



