名校
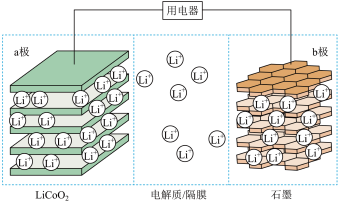
1 . 锂离子电池具有比能量大,用途广等特点。如图为一种锂离子电池的结构示意图,电池反应式为
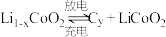 (x<1)。下列说法正确的是
(x<1)。下列说法正确的是

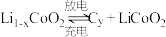 (x<1)。下列说法正确的是
(x<1)。下列说法正确的是
| A.充电时a极接外电源的负极 |
B.充电时,若转移1mol  ,石墨电极将增重7xg ,石墨电极将增重7xg |
C.放电时, 从石墨中脱嵌移向正极,嵌入钴酸锂晶体中 从石墨中脱嵌移向正极,嵌入钴酸锂晶体中 |
D.放电时, 极发生的电极反应为: 极发生的电极反应为: |
您最近一年使用:0次
2023-09-09更新
|
265次组卷
|
3卷引用:山西省运城市2023-2024学年高三上学期开学考试化学试题
22-23高一下·浙江·期中
解题方法
2 . 化学反应原理在生产、生活中用途广泛。
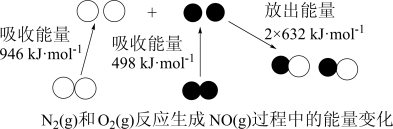
(1)汽车尾气中 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和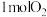 完全反应生成
完全反应生成 会
会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①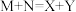 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则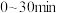 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为_______ 。

(3)实验室模拟热气循环法合成尿素, 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是_______ 。
A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗 同时生成
同时生成
D. ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1
E.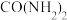 的质量保持不变
的质量保持不变
(4)在硫酸工业中,通过下列反应将 氧化成
氧化成 :
: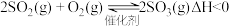 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:
结合表中信息,实际情况下最合理的生产条件为:_______。
(5)锂-氧气电池因其比能量非常高,具有广阔应用前景。下图是一种锂-氧气(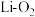 )电池的工作示意图,
)电池的工作示意图,
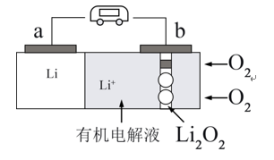
①电池放电时,b为_______ 极(填“正”或“负”),电极反应式为:_______ 。
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:_______ 。
(1)汽车尾气中
 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和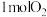 完全反应生成
完全反应生成 会
会 能量。
能量。
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①
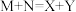 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则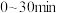 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为
(3)实验室模拟热气循环法合成尿素,
 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗
 同时生成
同时生成
D.
 ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1E.
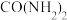 的质量保持不变
的质量保持不变(4)在硫酸工业中,通过下列反应将
 氧化成
氧化成 :
: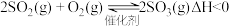 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:| 压强 |  | 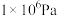 | 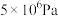 | 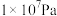 |
 时 时 的平衡转化率 的平衡转化率 | 97.5% | 99.2% | 99.6% | 99.7% |
 时 时 的平衡转化率 的平衡转化率 | 85.6% | 94.9% | 97.7% | 98.3% |
A. , ,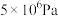 | B. , ,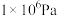 |
C. , , | D. , ,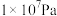 |
 )电池的工作示意图,
)电池的工作示意图,
①电池放电时,b为
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:
您最近一年使用:0次
3 . 下列物质的用途,利用了氧化还原反应的是
| A.明矾作净水剂 | B.铁粉作暖贴发热剂 |
| C.生石灰作食品干燥剂 | D.用熟石灰改良酸性土壤 |
您最近一年使用:0次
2022-09-09更新
|
222次组卷
|
4卷引用:北京市2022-2023学年高三上学期入学定位考试化学试题
解题方法
4 . 铝是重要的金属,有诸多用途.回答下列问题:
(1)利用铝与氧化铁可以焊接钢轨,写出发生反应的化学方程式__________ 。
(2)如图1为金属铝与1L盐酸反应生成氢气的物质的量与反应时间的关系。
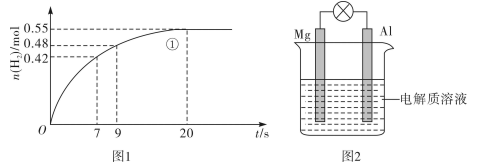
①0~20s范围内用盐酸浓度的变化表示该反应的平均速率为___________ (假定反应前后溶液体积不变);
②从图可以看出,0~7s反应速率最大,其原因是____________________ 。
(3)以Al、Mg为电极,可以组装一种原电池装置(如图2所示)。
①若电解质溶液为稀硫酸时,则Mg电极上发生的电极反应式为____________ ,当外电路有0.3mol电子转移时,Al电极上生成__________ L(标准状况)H2;
②若电解质溶液为NaOH溶液,则外电路中的电子_________ (填“流出”或“流入”)Al电极。
(1)利用铝与氧化铁可以焊接钢轨,写出发生反应的化学方程式
(2)如图1为金属铝与1L盐酸反应生成氢气的物质的量与反应时间的关系。

①0~20s范围内用盐酸浓度的变化表示该反应的平均速率为
②从图可以看出,0~7s反应速率最大,其原因是
(3)以Al、Mg为电极,可以组装一种原电池装置(如图2所示)。
①若电解质溶液为稀硫酸时,则Mg电极上发生的电极反应式为
②若电解质溶液为NaOH溶液,则外电路中的电子
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为________ ;滤渣Ⅰ的成分为MnO2、S和___________ (写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式_________________________ 。
④滤液Ⅱ经蒸发结晶得到的盐主要是______________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则电解过程中盐桥中Cl-移向______________ (填“甲池”或“乙池”)

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________ (填“减小”、“增大”或“不变”) ,乙池中石墨为________ 极(填“正”、“负”、“阴”或“阳”)。
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过
③“沉锰”(除Mn2+)过程中反应的离子方程式
④滤液Ⅱ经蒸发结晶得到的盐主要是
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则电解过程中盐桥中Cl-移向

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH
您最近一年使用:0次
2017-06-06更新
|
461次组卷
|
2卷引用:福建省莆田第一中学2017届高三考前模拟(最后一卷)化学试题



