名校
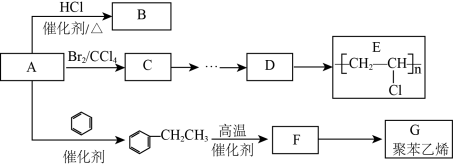
1 . Ⅰ.有机化合物A(相对分子质量为28)是重要的有机化工基础原料,其产量被用作衡量一个国家石油化工产业发展水平的标志。A与其他化合物之间的转化关系如图所示,回答下列问题。________________ 。
(2)上图中的 也可由B与
也可由B与 在
在 作催化剂的条件下合成,反应的化学方程式是
作催化剂的条件下合成,反应的化学方程式是_______________ ,反应类型是_______________ 。
Ⅱ.回答下列问题
(3)CO与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如下:
组合形成的质子交换膜燃料电池的结构示意图如下:__________________ 。若线路中转移2mol电子,则上述 燃料电池,消耗的
燃料电池,消耗的 在标准状况下的体积为
在标准状况下的体积为__________ L。
(4)2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为______________________ 。
(2)上图中的
 也可由B与
也可由B与 在
在 作催化剂的条件下合成,反应的化学方程式是
作催化剂的条件下合成,反应的化学方程式是Ⅱ.回答下列问题
(3)CO与
 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如下:
组合形成的质子交换膜燃料电池的结构示意图如下:
 燃料电池,消耗的
燃料电池,消耗的 在标准状况下的体积为
在标准状况下的体积为(4)2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为
您最近一年使用:0次
名校
2 . 原电池和电解池都能实现能量的转换。回答下列问题:
(1)银锌电池广泛用作各种电子仪器的电源,它的充电、放电过程可表示为2Ag+Zn(OH)2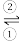 Ag2O+Zn+H2O,电池的放电过程是
Ag2O+Zn+H2O,电池的放电过程是___________ (填“①”或“②”),Ag2O电极发生的反应是___________ (填“氧化反应”或“还原反应”)。
(2)科学家预言,燃料电池将是21世纪获得电力的重要途径,在稀硫酸电解质中直接加入纯化后的甲醇 ,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为
,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为___________ 。
(3) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___________ ,欲除去Cu2+,最好选用下列试剂中的___________ (填字母)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(1)银锌电池广泛用作各种电子仪器的电源,它的充电、放电过程可表示为2Ag+Zn(OH)2
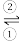 Ag2O+Zn+H2O,电池的放电过程是
Ag2O+Zn+H2O,电池的放电过程是(2)科学家预言,燃料电池将是21世纪获得电力的重要途径,在稀硫酸电解质中直接加入纯化后的甲醇
 ,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为
,同时向一个电极通入空气制得燃料电池,此电池的正极发生的电极反应为(3) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
A.NaOH B.Zn C.Fe D.NH3·H2O
您最近一年使用:0次
2024-04-25更新
|
105次组卷
|
2卷引用:江苏省扬州中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
3 . 以分子中只含一个碳原子的化合物为原料,用化工方法制造产品的化学体系总称为“一碳化学”。回答下列问题:
(1)CO(g)与H2O(g)在恒容密闭容器中反应:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①该反应的氧化剂是_______ (填化学式)。
②下列说法正确的是_______ (填字母)。
A.升高反应温度,可使CO完全转化
B.充入He,可加快反应速率
C.反应达到平衡后,反应速率为零
D.使用合适催化剂可以加快反应速率
③下列描述中能说明该反应达到平衡状态的是_______ 。
A.CO、H2和CO2三种物质的浓度相等
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molH2的同时消耗2molCO
(2)在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
①3~6min内,v(H2)=_______ 。
②第3min时
_______ 第9min时 (填“>”、“<”或“=”),第12min时,
(填“>”、“<”或“=”),第12min时,
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③求12min末时,混合气体中CH3OH的物质的量分数__________ 。(写出计算过程,要求列出三段式)【已知:B的物质的量分数=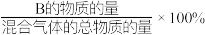 】
】
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH﹣﹣6e﹣= +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是_______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
(1)CO(g)与H2O(g)在恒容密闭容器中反应:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。①该反应的氧化剂是
②下列说法正确的是
A.升高反应温度,可使CO完全转化
B.充入He,可加快反应速率
C.反应达到平衡后,反应速率为零
D.使用合适催化剂可以加快反应速率
③下列描述中能说明该反应达到平衡状态的是
A.CO、H2和CO2三种物质的浓度相等
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molH2的同时消耗2molCO
(2)在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | a | 0.75 | 0.75 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
②第3min时

 (填“>”、“<”或“=”),第12min时,
(填“>”、“<”或“=”),第12min时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③求12min末时,混合气体中CH3OH的物质的量分数
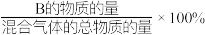 】
】(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH﹣﹣6e﹣=
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近一年使用:0次
名校
解题方法
4 . 中国将力争2030年前实现碳达峰、2060年前实现碳中和。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳排放。回答下列问题:
(1)某温度下,CO2与H2制甲醇的反应为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)∆H<0(放热),将6molCO2和8molH2充入2L的恒温刚性密闭容器中,测得氢气物质的量随时间变化如图所示。下列说法不能表明该反应已经达到平衡状态的是_______ 。

A.v正(CO2)=3v逆(H2)
B.混合气体的平均相对分子质量不变
C.n(CO2):n(H2)保持不变
D.压强保持不变
E.容器中CH3OH浓度与H2O浓度之比为1:1
(2)a点正反应速率_______ (填大于、等于或小于)b点逆反应速率。
(3)平衡时CO2的转化率为_______ (保留一位小数)。
(4)求a到c点的时间段H2的反应速率v(H2)=_______ (保留两位小数)。
(5)甲醇(CH3OH)是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示:

电极A为燃料电池的_______ (填“正”或“负”)极,该电极反应式为:_______ 。
(6)当电路中通过1mol电子时,在电极B附近消耗O2的质量为_______ g;电池工作一段时间后,电解质溶液的碱性_______ (填“增强”、“减弱”或“不变”)。
(1)某温度下,CO2与H2制甲醇的反应为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)∆H<0(放热),将6molCO2和8molH2充入2L的恒温刚性密闭容器中,测得氢气物质的量随时间变化如图所示。下列说法不能表明该反应已经达到平衡状态的是

A.v正(CO2)=3v逆(H2)
B.混合气体的平均相对分子质量不变
C.n(CO2):n(H2)保持不变
D.压强保持不变
E.容器中CH3OH浓度与H2O浓度之比为1:1
(2)a点正反应速率
(3)平衡时CO2的转化率为
(4)求a到c点的时间段H2的反应速率v(H2)=
(5)甲醇(CH3OH)是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示:

电极A为燃料电池的
(6)当电路中通过1mol电子时,在电极B附近消耗O2的质量为
您最近一年使用:0次
解题方法
5 . 如图所示,是原电池的装置图。请回答:___________ ; 在反应中溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C的pH___________ (填“升高”“降低”或“基本不变”)
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ , B极电极反应式为___________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:___________ (填“正极”或“负极”),若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
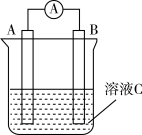
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
您最近一年使用:0次
名校
解题方法
6 . 将CO合成甲醇是实现“碳达峰、碳中和”的一项重要措施,在此过程中可能涉及以下物质:
①H2②O2③CO④He⑤H2O2⑥Na2O2⑦KOH⑧CH3OH⑨K2CO3
请判断:
(1)含有极性共价键的离子化合物有___________ (填编号)。
(2)含有非极性共价键的共价化合物有___________ (填编号)。
(3)在实验室中模拟CO合成甲醇的反应,在2L密闭容器内,400℃时发生反应:CO(g)+2H2(g)⇌CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
已知每生成1molCH3OH(g),放出的热量为116kJ。计算上述反应达到平衡时放出的热量Q=___________ kJ(保留2位有效数字)。
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O。则电池放电时通入空气的电极为
+6H2O。则电池放电时通入空气的电极为___________ (“正”或“负”)极;从电极反应来看,每消耗1molCH3OH转移的电子数为___________ NA。
①H2②O2③CO④He⑤H2O2⑥Na2O2⑦KOH⑧CH3OH⑨K2CO3
请判断:
(1)含有极性共价键的离子化合物有
(2)含有非极性共价键的共价化合物有
(3)在实验室中模拟CO合成甲醇的反应,在2L密闭容器内,400℃时发生反应:CO(g)+2H2(g)⇌CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2
 +6H2O。则电池放电时通入空气的电极为
+6H2O。则电池放电时通入空气的电极为
您最近一年使用:0次
2023-08-10更新
|
224次组卷
|
2卷引用:山东省济南市2022-2023学年高一下学期期中考试化学试题
名校
解题方法
7 . 人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛应用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极的电极反应式为___________ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应:2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为___________ ,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为___________ g。
(3)燃料电池是一种高效、安全环保的供电装置,以甲醇作燃料的电池,如下图所示:

①负极反应物是___________ ,H+从___________ (填“a”或“b”,下同)极移动到___________ 极。
②正极反应式为___________ 。
(1)铅蓄电池在放电时发生的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极的电极反应式为
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应:2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为
(3)燃料电池是一种高效、安全环保的供电装置,以甲醇作燃料的电池,如下图所示:

①负极反应物是
②正极反应式为
您最近一年使用:0次
名校
8 . 人们应用原电池原理制作了多种电池,以满足不同的需要。以下是几种不同形式的原电池装置,请根据题中提供的信息,填写空格。
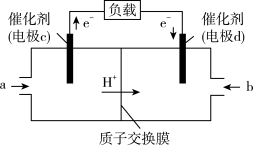
(1)某原电池的装置如图1所示。若需将反应
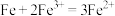 设计成如图1所示的原电池装置,则A(负极)极材料为
设计成如图1所示的原电池装置,则A(负极)极材料为
(2)如图2是一个双液原电池装置图,下列说法正确的是 (填字母)。

A.盐桥中的阴离子向 溶液移动 溶液移动 | B.电子流动方向为Zn→盐桥→Cu |
| C.铜片作电池的正极 | D.该电池比单液原电池的电流更稳定 |
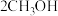 和
和 组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为
组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为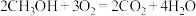 ,则a处充入的是
,则a处充入的是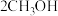 燃料电池消耗的
燃料电池消耗的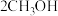 的质量为
的质量为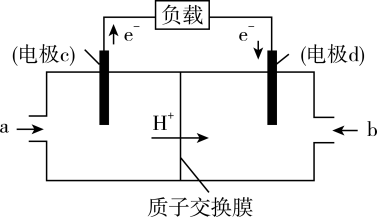
您最近一年使用:0次
2023-07-21更新
|
154次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2022-2023学年高一下学期7月期末化学试题
解题方法
9 . 甲醇 是一种重要的化工原料和新型燃料。甲醇、空气和
是一种重要的化工原料和新型燃料。甲醇、空气和 溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是

 是一种重要的化工原料和新型燃料。甲醇、空气和
是一种重要的化工原料和新型燃料。甲醇、空气和 溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
溶液组成的燃料电池的简易装置如图所示。下列有关说法正确的是
A. 为电源的负极 为电源的负极 |
B. 电极反应式为 电极反应式为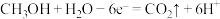 |
C. 极每消耗 极每消耗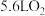 ,电路中则转移 ,电路中则转移 电子 电子 |
D.电池工作一段时间后,电解质溶液的 值变小 值变小 |
您最近一年使用:0次
名校
10 . 化学反应与能量,是学习和研究化学原理的重要内容。在2L的恒容密闭容器中充入1molCO和2mol ,一定条件下发生反应:
,一定条件下发生反应: ,测得CO和
,测得CO和 (g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
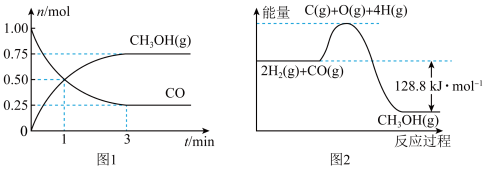
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率
___________  。下列措施能增大反应速率的是
。下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)下列描述中能说明上述反应达到平衡状态的是___________。
(3)平衡时CO的体积分数(即物质的量分数)为___________ (保留3位有效数字)。
(4)该反应是___________ 反应(填“吸热”或“放热”),已知断开1molCO(g)和2mol (g)中的化学键需要吸收的能量为1924kJ,则断开1mol
(g)中的化学键需要吸收的能量为1924kJ,则断开1mol (g)中的化学键所需要吸收
(g)中的化学键所需要吸收________ kJ的能量。
(5) 归燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为
归燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为 。则下列说法正确的是
。则下列说法正确的是___________ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4g 转移1.2mol电子
转移1.2mol电子
 ,一定条件下发生反应:
,一定条件下发生反应: ,测得CO和
,测得CO和 (g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率

 。下列措施能增大反应速率的是
。下列措施能增大反应速率的是A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)下列描述中能说明上述反应达到平衡状态的是___________。
A.CO、 和 和 三种物质的浓度相等 三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
D.单位时间内消耗2mol 的同时生成1mol 的同时生成1mol |
(4)该反应是
 (g)中的化学键需要吸收的能量为1924kJ,则断开1mol
(g)中的化学键需要吸收的能量为1924kJ,则断开1mol (g)中的化学键所需要吸收
(g)中的化学键所需要吸收(5)
 归燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为
归燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为 。则下列说法正确的是
。则下列说法正确的是①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4g
 转移1.2mol电子
转移1.2mol电子
您最近一年使用:0次



