解题方法
1 . Ⅰ.如图所示是原电池的装置图。请回答:

(1)若 为稀
为稀 ,电流表指针发生偏转,
,电流表指针发生偏转, 电极材料为
电极材料为 且作负极,则
且作负极,则 电极上发生的电极反应式为
电极上发生的电极反应式为___________ ;反应进行一段时间后溶液酸性将___________ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应: 设计成如图所示的原电池装置,则A(正极
设计成如图所示的原电池装置,则A(正极 极材料为
极材料为___________ ,B(负极)极材料为___________ ,溶液 为
为___________ 。
Ⅱ.我国芒硝(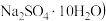 的储量丰富,它是重要的化工原料。
的储量丰富,它是重要的化工原料。
(3)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出 晶体,其反应的化学方程式是
晶体,其反应的化学方程式是___________ 。
②已知:i.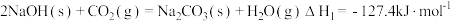
ii.
反应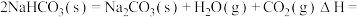
___________  。
。
(4)制备烧碱和硫酸。

用如图所示装置,以惰性电极进行电解,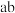 、
、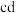 均为离子交换膜。则阴极区制备的溶液是
均为离子交换膜。则阴极区制备的溶液是_______ ,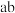 为
为___________ (填“阴”和“阳”)离子交换膜。阳极的电极反应式是__________ 。

(1)若
 为稀
为稀 ,电流表指针发生偏转,
,电流表指针发生偏转, 电极材料为
电极材料为 且作负极,则
且作负极,则 电极上发生的电极反应式为
电极上发生的电极反应式为(2)若需将反应:
 设计成如图所示的原电池装置,则A(正极
设计成如图所示的原电池装置,则A(正极 极材料为
极材料为 为
为Ⅱ.我国芒硝(
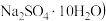 的储量丰富,它是重要的化工原料。
的储量丰富,它是重要的化工原料。(3)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出
 晶体,其反应的化学方程式是
晶体,其反应的化学方程式是②已知:i.
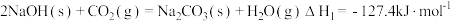
ii.

反应
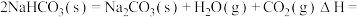
 。
。(4)制备烧碱和硫酸。

用如图所示装置,以惰性电极进行电解,
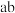 、
、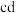 均为离子交换膜。则阴极区制备的溶液是
均为离子交换膜。则阴极区制备的溶液是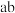 为
为
您最近一年使用:0次
名校
解题方法
2 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”成“负极”);
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_______ ,反应一段时间,硫酸铜溶液浓度将_______ (填“增大”、“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,生成氢气的分子数为_______ ,丙装置中阴极析出铜的质量为_______ g;
(5)某同学利用甲醚燃料电池设计电解法制取漂白液或 的实验装置(如图所示);
的实验装置(如图所示);
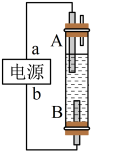
①若用于制漂白液,a为电池的_______ (填“正极”成“负极”),电解质溶液最好用_______ ;
②若用于制 ,使用硫酸钠溶液作电解质溶液,阳极选用
,使用硫酸钠溶液作电解质溶液,阳极选用_______ 作电级。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为
(4)若在标准状况下,有2.24L氧气参加反应,生成氢气的分子数为
(5)某同学利用甲醚燃料电池设计电解法制取漂白液或
 的实验装置(如图所示);
的实验装置(如图所示);
①若用于制漂白液,a为电池的
②若用于制
 ,使用硫酸钠溶液作电解质溶液,阳极选用
,使用硫酸钠溶液作电解质溶液,阳极选用
您最近一年使用:0次
2022-10-30更新
|
63次组卷
|
2卷引用:河北省唐山市开滦第二中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
3 . I.氨氧燃料电池具有很大的发展潜力。
(1)氨氧燃料电池工作原理如图所示。
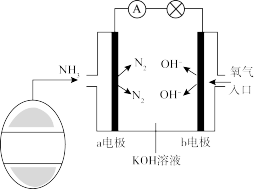
a电极的电极反应式是___________ ;
(2)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:
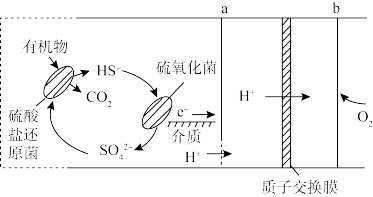
 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式是
的电极反应式是___________ 。
(3)近年来将氯化氢转化为氯气的技术成为科学研究的热点。在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
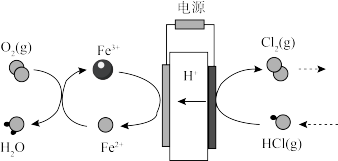
阴极区发生的反应有_____________ (写反应方程式)。电路中转移1mol电子,需消耗氧气___________ L(标准状况)。
Ⅱ.如图X是直流电源。Y池中c、d为石墨棒,Z池中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
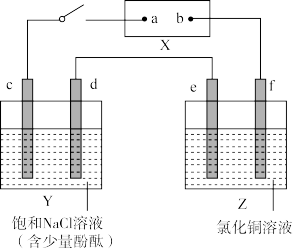
(4)①b为电源的___________ 极(填“正”“负”“阴”或“阳”,下同)。
②z池中e为___________ 极。
③连接Y、Z池线路,电子流动的方向是d___________ e(用“→”或“←”填空)。
(5)①写出c极上反应的电极反应式:___________ 。
②写出Y池中总反应的化学方程式:___________ 。
③写出Z池中e极上反应的电极反应式:___________ 。
(1)氨氧燃料电池工作原理如图所示。

a电极的电极反应式是
(2)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示:

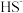 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式是
的电极反应式是(3)近年来将氯化氢转化为氯气的技术成为科学研究的热点。在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:

阴极区发生的反应有
Ⅱ.如图X是直流电源。Y池中c、d为石墨棒,Z池中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(4)①b为电源的
②z池中e为
③连接Y、Z池线路,电子流动的方向是d
(5)①写出c极上反应的电极反应式:
②写出Y池中总反应的化学方程式:
③写出Z池中e极上反应的电极反应式:
您最近一年使用:0次
名校
解题方法
4 . 金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )
| A.阳极发生还原反应,其电极反应式:Ni2++2e-═Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Pt |
您最近一年使用:0次
10-11高三·河北衡水·阶段练习
5 . 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)画出B的离子结构示意图______ ;写出D元素最高价氧化物的水化物电子式_________
(2)盐X水溶液显____ (填“酸”“碱”“中”)性,用离子方程式解释其原因________________
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为________
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是________________________________
(5)如右图是一个电解过程示意图。
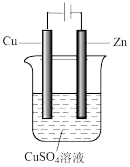
假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)_______________ L
| 元素 | 有关信息 |
| A | 元素主要化合价为—2,原子半径为0.074 n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(2)盐X水溶液显
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是
(5)如右图是一个电解过程示意图。

假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)
您最近一年使用:0次
名校
6 . 用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是
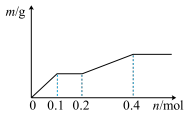

| A.Ag+>X3+>Cu2+>H+>X2+ |
| B.Ag+>Cu2+>X3+>H+>X2+ |
| C.Cu2+>X3+>Ag+>X2+ >H+ |
| D.Cu2+>Ag+>X3+>H+>X2+ |
您最近一年使用:0次
2016-06-02更新
|
203次组卷
|
8卷引用:2016届河北省衡水市冀州中学高三下仿真二理综化学试卷
7 . 亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,在室温下立即分解。
(1)写出HNO2的电离方程式________________ 。
(2)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式______________ 。
(3)要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质适合使用是_____ (填序号)。写出该反应的化学方程式__________________ 。
a.稀硫酸b.二氧化碳c.二氧化硫
(4)建筑工业盐(NaNO2)与食盐外观很相似,溶液也都是无色,鉴别它们时,可将两种盐溶液分别加入酸性K2Cr2O7溶液中,加食盐水的无明显现象,加建筑工业盐溶液的溶液由橙色变为绿色(Cr3+的颜色),无气体放出,完成该反应的离子方程式________________ 。
(5)若改用电解法将废水中NO2-转换为N2除去,N2将在____________ (填电极名称)生成。
(6)若工业废水中的NO2-的浓度约为1.0×10-6mol/L,取工业废水5mL于试管中,滴加1滴0.1 mol/L的硝酸银溶液(1滴为0.05mL),能否看到沉淀?________ (假设溶液体积始终为5mL,通过计算说明,已知Ksp(AgNO2)=2×10-8),____________ 。
(1)写出HNO2的电离方程式
(2)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式
(3)要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质适合使用是
a.稀硫酸b.二氧化碳c.二氧化硫
(4)建筑工业盐(NaNO2)与食盐外观很相似,溶液也都是无色,鉴别它们时,可将两种盐溶液分别加入酸性K2Cr2O7溶液中,加食盐水的无明显现象,加建筑工业盐溶液的溶液由橙色变为绿色(Cr3+的颜色),无气体放出,完成该反应的离子方程式
(5)若改用电解法将废水中NO2-转换为N2除去,N2将在
(6)若工业废水中的NO2-的浓度约为1.0×10-6mol/L,取工业废水5mL于试管中,滴加1滴0.1 mol/L的硝酸银溶液(1滴为0.05mL),能否看到沉淀?
您最近一年使用:0次



