名校
解题方法
1 . 回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解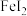 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应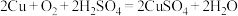 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为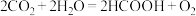 ,装置如图所示:
,装置如图所示:
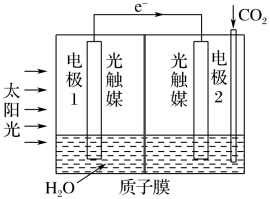
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
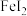 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
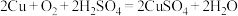 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为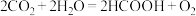 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式
您最近一年使用:0次
解题方法
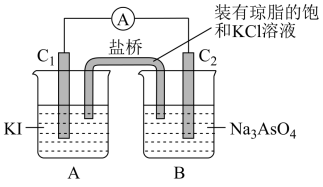
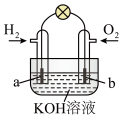
2 . 某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。

(1)通电一段时间后,可观察到_______ 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为_______ 。
(2)该溶液电解反应的化学方程式为_______ 。
(3)若开始时改用银棒做阳极,阳极的电极反应式为_______ 。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为_______ 。

(1)通电一段时间后,可观察到
(2)该溶液电解反应的化学方程式为
(3)若开始时改用银棒做阳极,阳极的电极反应式为
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为

您最近一年使用:0次
3 . 如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确 的是


| A.该装置是将电能转化为化学能的装置 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为2Cl-+2H+ Cl2+2H2 Cl2+2H2 |
| D.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
您最近一年使用:0次
名校
解题方法
4 . 电化学降解 的原理如图所示,下列说法正确的是
的原理如图所示,下列说法正确的是
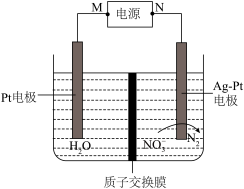
 的原理如图所示,下列说法正确的是
的原理如图所示,下列说法正确的是
| A.N为电源的正极 |
B.电池工作时, 通过质子交换膜从左侧移向右侧 通过质子交换膜从左侧移向右侧 |
C.Pt电极上的反应式为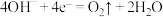 |
D.每生成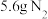 ,左右两侧溶液质量变化差为18g ,左右两侧溶液质量变化差为18g |
您最近一年使用:0次
2022-11-21更新
|
520次组卷
|
6卷引用:天津市南开中学2022-2023学年高二上学期期末考试化学试题
天津市南开中学2022-2023学年高二上学期期末考试化学试题山东省济南市章丘区第四中学2022-2023学年高二上学期期中考试化学试题河南省洛阳市名校2022-2023学年高二上学期12月联考化学试题河南省洛阳市洛宁县第一高级中学2022-2023学年高二上学期12月月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第4单元02基础练(已下线)选择题11-16
解题方法
5 . 电化学理论在钢铁防腐、废水处理中有着重要应用价值。请按要求回答下列问题。
(1)在潮湿的空气里,钢铁易发生电化学腐蚀,其中正极的电极反应式为_______ 。
(2)在海洋工程上,通常用铝锌镉合金(金属性:Al Zn
Zn Cd)保护海底钢铁设施,其原理如图所示:
Cd)保护海底钢铁设施,其原理如图所示:
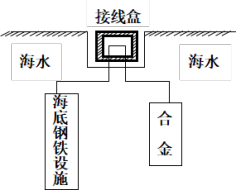
其负极电极反应式为_______ ;在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是_______ 。
(3)工业上处理含 的酸性工业废水常用以下方法:
的酸性工业废水常用以下方法:
a.往工业废水里加入适量的NaCl,搅拌均匀
b.用Fe作电极进行电解,一段时间后有Cr(OH)3和Fe(OH)3沉淀产生
c.过滤回收沉淀,废水达到排放标准
①电解时阳极反应式:_______ 。
② 转变成Cr3+的离子方程式:
转变成Cr3+的离子方程式:_______ 。
③解释Cr(OH)3、Fe(OH)3沉淀的产生原因:_______ 。
④能否用Cu电极来代替Fe电极?_______ (填“能”或“不能”),简述理由:_______ 。
(1)在潮湿的空气里,钢铁易发生电化学腐蚀,其中正极的电极反应式为
(2)在海洋工程上,通常用铝锌镉合金(金属性:Al
 Zn
Zn Cd)保护海底钢铁设施,其原理如图所示:
Cd)保护海底钢铁设施,其原理如图所示:
其负极电极反应式为
(3)工业上处理含
 的酸性工业废水常用以下方法:
的酸性工业废水常用以下方法:a.往工业废水里加入适量的NaCl,搅拌均匀
b.用Fe作电极进行电解,一段时间后有Cr(OH)3和Fe(OH)3沉淀产生
c.过滤回收沉淀,废水达到排放标准
①电解时阳极反应式:
②
 转变成Cr3+的离子方程式:
转变成Cr3+的离子方程式:③解释Cr(OH)3、Fe(OH)3沉淀的产生原因:
④能否用Cu电极来代替Fe电极?
您最近一年使用:0次
名校
6 . 设NA代表阿伏加德罗常量的值。下列说法正确的是
| A.100g46%乙醇溶液中含有的氧原子数为4NA |
| B.标准状况下,11.2L乙烷和乙烯混合物中含有的氢原子数为2.5NA |
| C.2molNO与1molO2在密闭容器中充分反应后,容器中的分子总数为2NA |
| D.用铜作电极电解饱和NaCl溶液,当电路上通过0.2mole-时,阴、阳两极产生的气体分子总数为0.2NA |
您最近一年使用:0次
2022-09-02更新
|
700次组卷
|
6卷引用:天津市第十四中学2022-2023学年高三上学期期末考试化学试题
天津市第十四中学2022-2023学年高三上学期期末考试化学试题江西省五市九校2022-2023学年高三上学期第一次联考化学试题湖南省汉寿县第二中学2022-2023学年高三上学期第二次月考化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A湖南省株洲市第一中学2022-2023学年高三上学期第五次月考化学试题(已下线)回归教材重难点03 “NA”应用再思考-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
2022高三·全国·专题练习
7 . 一种采用 和
和 为原料制备
为原料制备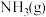 的装置示意图如下。
的装置示意图如下。
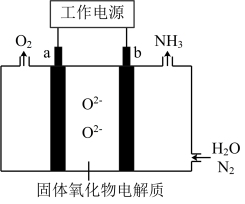
下列有关说法正确的是
 和
和 为原料制备
为原料制备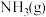 的装置示意图如下。
的装置示意图如下。
下列有关说法正确的是
A.在b电极上, 被还原 被还原 |
| B.金属Ag可作为a电极的材料 |
| C.改变工作电源电压,反应速率不变 |
D.电解过程中,固体氧化物电解质中 不断减少 不断减少 |
您最近一年使用:0次
2022-07-04更新
|
12208次组卷
|
33卷引用:天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2022-2023学年高一下学期期末化学试题(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题1-14(已下线)第19讲 电解池 金属的电化学腐蚀与防护(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第16讲 原电池 新型电源 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题广东省惠州市2022-2023学年高三上学期第二次调研考试 化学试题(已下线)专题05 化学能与电能的转化(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题十一 化学能与电能-实战高考·二轮复习核心突破重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题11 新型电池和电解原理的应用(已下线)专题三 新型电池(练习)(已下线)专题四 电解池的工作原理及其应用(练习)(已下线)回归教材重难点07 重温“两池”原理-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题九 电化学装置图(练)(已下线)题型17 燃料电池的应用广东省惠州市2022-2023学年高三上学期第二次调研考试化学试题(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用(已下线)第17练 电解原理及其应用 金属腐蚀与防护 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题07 电化学及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)专题10 电化学及其应用-2023年高考化学真题题源解密(全国通用)作业(二十四) 电解原理(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 电解池 金属的电化学腐蚀与防护(已下线)考点2 原电池 新型电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 电解池 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省哈尔滨市德强高级中学2023-2024学年高三上学期期中考试化学试题河北省石家庄市辛集市育才中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
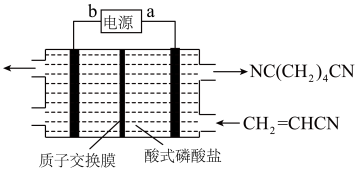
8 . 制造尼龙-66的原料己二腈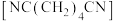 用量很大,现代工业常用电合成丙烯腈法制备,总反应是
用量很大,现代工业常用电合成丙烯腈法制备,总反应是 ,装置如图:下列说法正确的是
,装置如图:下列说法正确的是
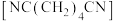 用量很大,现代工业常用电合成丙烯腈法制备,总反应是
用量很大,现代工业常用电合成丙烯腈法制备,总反应是 ,装置如图:下列说法正确的是
,装置如图:下列说法正确的是
| A.电子从电源a极流出,经溶液流回b极 |
B. 中C原子的杂化方式均为 中C原子的杂化方式均为 |
C.阴极电极反应为: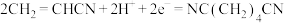 |
D.当生成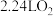 时,电路中通过 时,电路中通过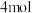 电子 电子 |
您最近一年使用:0次
2022-05-30更新
|
273次组卷
|
2卷引用:天津市第十四中学2022-2023学年高三上学期期末考试化学试题
名校
9 . 太阳能光伏电池电解水制高纯氢的工作示意图如下。下列相关叙述不正确的是
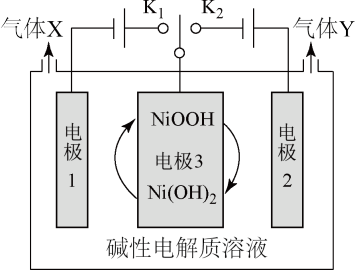

A.连接 时电极1附近pH降低 时电极1附近pH降低 |
B.连接 时,溶液中的阴离子向电极2迁移 时,溶液中的阴离子向电极2迁移 |
C.连接 时电极3上NiO(OH)被还原为 时电极3上NiO(OH)被还原为 |
D.交替连接 、 、 时,电极3附近的 时,电极3附近的 也会交替消耗和生成 也会交替消耗和生成 |
您最近一年使用:0次
2022-05-18更新
|
289次组卷
|
2卷引用:天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题
10 . 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为 。回答下列问题:
。回答下列问题:
(1)一定温度下,下列措施能加快反应 的速率的是_________(填选项字母)。
的速率的是_________(填选项字母)。
(2)恒温恒容条件下,在密闭容器中通入物质的量比为 的
的 和
和 发生反应。下列描述能说明反应达到平衡状态的是___________(填序号)。
发生反应。下列描述能说明反应达到平衡状态的是___________(填序号)。
(3)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为 、
、 和
和 。
。

据图可知,该反应为反应______ (填“放热”或“吸热”)。设CO2的初始浓度为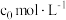 ,根据
,根据 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数
______ (列出计算式即可)。若在 时减小投料比
时减小投料比 ,则CO2的平衡转化率曲线可能位于II线的
,则CO2的平衡转化率曲线可能位于II线的_____ (填“上方”或“下方”)。
(4)采用甲醇燃料电池电解法可以制取有广泛用途的 ,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。阳极区的电极反应式为
,镍电极有气泡产生。阳极区的电极反应式为____ ,当铁电极质量减少 时,镍电极产生气体的体积为
时,镍电极产生气体的体积为____ L(标准状况)。

 。回答下列问题:
。回答下列问题:(1)一定温度下,下列措施能加快反应
 的速率的是_________(填选项字母)。
的速率的是_________(填选项字母)。| A.及时移去甲醇 | B.加入催化剂 | C.提高反应物浓度 | D.增大容器体积 |
 的
的 和
和 发生反应。下列描述能说明反应达到平衡状态的是___________(填序号)。
发生反应。下列描述能说明反应达到平衡状态的是___________(填序号)。A.体系中 ,且保持不变 ,且保持不变 |
| B.容器内的混合气体的密度保持不变 |
| C.水分子中断裂2NA个H-O键,同时断裂3NA个H-H键 |
D. 和 和 的浓度之比保持不变 的浓度之比保持不变 |
 、
、 和
和 。
。
据图可知,该反应为反应
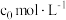 ,根据
,根据 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数
 时减小投料比
时减小投料比 ,则CO2的平衡转化率曲线可能位于II线的
,则CO2的平衡转化率曲线可能位于II线的(4)采用甲醇燃料电池电解法可以制取有广泛用途的
 ,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。阳极区的电极反应式为
,镍电极有气泡产生。阳极区的电极反应式为 时,镍电极产生气体的体积为
时,镍电极产生气体的体积为
您最近一年使用:0次



