名校
1 . 工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.
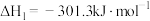 ;
;
 Ⅱ.
Ⅱ.
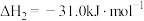 。
。
则CO与 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为___________ 。
(2)某科研小组在 作催化剂的条件下,在500℃时,研究了
作催化剂的条件下,在500℃时,研究了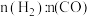 分别为
分别为 、
、 时CO的转化率变化情况(如图1所示),则图中表
时CO的转化率变化情况(如图1所示),则图中表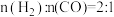 的变化曲线为:
的变化曲线为:___________ (填“曲线a”或“曲线b”)。 合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图2所示。下列说法正确的是
的产率与温度的关系如图2所示。下列说法正确的是___________ (填字母)。
b.在恒温恒压的平衡体系中充入氩气, 的产率降低
的产率降低
c.当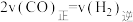 时,反应达到平衡状态
时,反应达到平衡状态
d.降低生成物甲醇的浓度,有利于提高甲醇的产率,加快反应速率
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲容器平衡后气体的压强为开始时的 ,则该温度下,该反应的平衡常数K=
,则该温度下,该反应的平衡常数K=___________ ,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为___________ 。
(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇( )和氧化锆(
)和氧化锆( )晶体,能传导
)晶体,能传导 。则负极的电极反应式为
。则负极的电极反应式为___________ 。
②碳酸二甲酯 毒性小,是一种绿色化工产品,用CO合成
毒性小,是一种绿色化工产品,用CO合成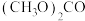 ,其电化学合成原理为
,其电化学合成原理为 ,装置如图3所示,写出阳极的电极反应式:
,装置如图3所示,写出阳极的电极反应式:___________ 。
(1)已知:Ⅰ.

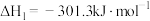 ;
; Ⅱ.
Ⅱ.
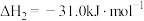 。
。则CO与
 合成气态甲醇的热化学方程式为
合成气态甲醇的热化学方程式为(2)某科研小组在
 作催化剂的条件下,在500℃时,研究了
作催化剂的条件下,在500℃时,研究了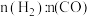 分别为
分别为 、
、 时CO的转化率变化情况(如图1所示),则图中表
时CO的转化率变化情况(如图1所示),则图中表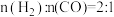 的变化曲线为:
的变化曲线为: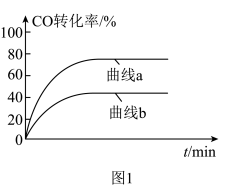
 合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得 的产率与温度的关系如图2所示。下列说法正确的是
的产率与温度的关系如图2所示。下列说法正确的是
b.在恒温恒压的平衡体系中充入氩气,
 的产率降低
的产率降低c.当
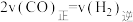 时,反应达到平衡状态
时,反应达到平衡状态d.降低生成物甲醇的浓度,有利于提高甲醇的产率,加快反应速率
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物起始投入量 | 2molCO、 | amolCO、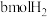 、 、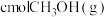 (a、b、c均不为零) (a、b、c均不为零) |
 ,则该温度下,该反应的平衡常数K=
,则该温度下,该反应的平衡常数K=(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(
 )和氧化锆(
)和氧化锆( )晶体,能传导
)晶体,能传导 。则负极的电极反应式为
。则负极的电极反应式为②碳酸二甲酯
 毒性小,是一种绿色化工产品,用CO合成
毒性小,是一种绿色化工产品,用CO合成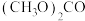 ,其电化学合成原理为
,其电化学合成原理为 ,装置如图3所示,写出阳极的电极反应式:
,装置如图3所示,写出阳极的电极反应式: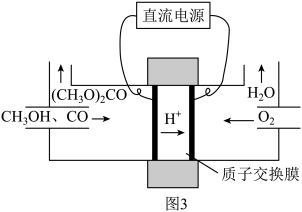
您最近一年使用:0次
名校
2 . I.某实验小组同学利用如图装置对电化学原理进行了一系列探究活动。
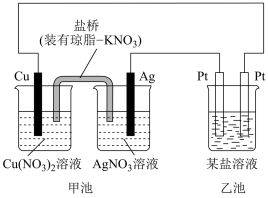
(1)甲池装置为_______ (填“原电池”或“电解池”)。
(2)甲池反应前两电极质量相等,一段时间后,两电极质量相差14g,导线中通过_______ mol电子。
(3)实验过程中,甲池左侧烧杯中 的浓度
的浓度_______ (填“增大”、“减小”或“不变”)。
(4)若乙池中溶液为足量的硝酸银溶液,工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入_______ 。(填化学式)
(5)若把乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为 溶液,则下列说法正确的是_______。
溶液,则下列说法正确的是_______。
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图,其中电极未标出,所用离子交换膜只允许阳离子通过。

(6)电解池A中发生的电解化学方程式是_______ 。
(7)图中Y是_______ (填化学式),若电解产生11.2L(标准状况)该物质,则至少转移电子_______ mol;
(8)分析图可知:氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

(1)甲池装置为
(2)甲池反应前两电极质量相等,一段时间后,两电极质量相差14g,导线中通过
(3)实验过程中,甲池左侧烧杯中
 的浓度
的浓度(4)若乙池中溶液为足量的硝酸银溶液,工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入
(5)若把乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为
 溶液,则下列说法正确的是_______。
溶液,则下列说法正确的是_______。| A.电解过程中,阳极减少的质量与阴极增加的质量相等 |
| B.乙池左侧电极为粗铜,发生氧化反应 |
C. 溶液的浓度保持不变 溶液的浓度保持不变 |
| D.杂质都将以单质的形式沉淀到池底 |
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图,其中电极未标出,所用离子交换膜只允许阳离子通过。

(6)电解池A中发生的电解化学方程式是
(7)图中Y是
(8)分析图可知:氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
名校
解题方法
3 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为离子交换膜。请按要求回答相关问题:
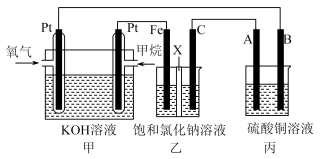
(1)甲烷燃料电池负极反应式是___________ 。
(2)Fe电极的电极反应式为___________ 。
(3)X选择___________ 离子交换膜(填“阴”,“阳”)。
(4)丙模拟粗铜的精炼,那么粗铜放在___________ (填“A”,“B”)极,反应结束后硫酸铜溶液的浓度___________ (填“变大”,“变小”,“不变”)。
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L。
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
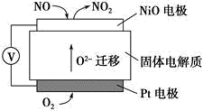
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________ 。

(1)甲烷燃料电池负极反应式是
(2)Fe电极的电极反应式为
(3)X选择
(4)丙模拟粗铜的精炼,那么粗铜放在
(5)若在标准状况下,有1.12 L氧气参加反应,则乙装置中铁极上生成的气体体积为
(6)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
名校
4 .  、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时,8.0g 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)水煤气中的CO和 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。

①从反应开始到6分钟,CO的平均反应速率___________ ,6分钟时,H2的转化率为___________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ 。(填字母)
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中 的质量分数保持不变
的质量分数保持不变
d.单位时间内每消耗1molCO,同时生成1mol
(3)甲烷燃料电池装置图如图-2,电池总反应为 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。
①通入氧气的电极为电池的___________ (填“正极”或“负极”)
②若通入0.1mol 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。___________ 。
 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。(1)25℃,101kPa时,8.0g
 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:(2)水煤气中的CO和
 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。
①从反应开始到6分钟,CO的平均反应速率
②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中
 的质量分数保持不变
的质量分数保持不变d.单位时间内每消耗1molCO,同时生成1mol

(3)甲烷燃料电池装置图如图-2,电池总反应为
 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。①通入氧气的电极为电池的
②若通入0.1mol
 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
您最近一年使用:0次
2021-06-28更新
|
292次组卷
|
2卷引用:天津市耀华中学2022-2023学年高三上学期统练二化学试题
名校
解题方法
5 . 降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
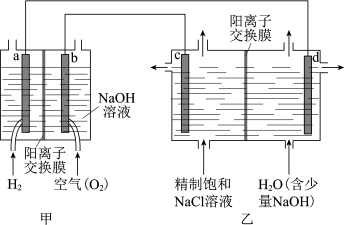
①a极为_______ (填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为。_______ 。
③下列说法正确的是_______ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为_______ 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是_______ 。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为_______ 。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。

①a极为
②乙装置中电解饱和NaCl溶液的化学方程式为。
③下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
您最近一年使用:0次
2022-04-12更新
|
208次组卷
|
9卷引用:天津市武清区杨村第一中学2023-2024学年高三上学期第三次质量检测化学试题
天津市武清区杨村第一中学2023-2024学年高三上学期第三次质量检测化学试题北京市西城区2020-2021学年高二上学期期末考试化学试题江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京三中2021-2022学年高二上学期期中考试化学试题江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省永吉县第四中学2022-2023学年高二上学期期末考试化学试题
6 . 氮氧化物、硝酸盐废水都会给环境带来污染。图甲是监测NO含量的传感器的工作原理示意图,图乙是电化学降解酸性废水中NO 的工作原理示意图。下列有关叙述
的工作原理示意图。下列有关叙述错误 的是

 的工作原理示意图。下列有关叙述
的工作原理示意图。下列有关叙述
| A.图甲中,Pt电极上发生的是还原反应 |
| B.图甲中,NiO电极上的电极反应式为NO+O2--2e-=NO2 |
| C.图乙中,H+由电解池右侧移向左侧 |
D.图乙中,阴极反应式为2NO +10e-+12H+=6H2O+N2↑ +10e-+12H+=6H2O+N2↑ |
您最近一年使用:0次



