2022·安徽黄山·二模
名校
解题方法
1 . 羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为CO2和H2O的原电池-电解池组合装置(如下图所示),该装置能实现发电、环保二位一体。下列说法错误 的是
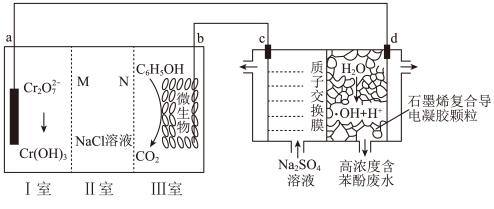

| A.b极为负极,d极为阳极 |
| B.b电极区每产生3molCO2,c电极区溶液质量减轻14g |
| C.d电极的电极反应式:H2O-e-=·OH+H+ |
| D.工作时,如果II室中Na+、Cl− 数目都减小,则M为阳离子交换膜 |
您最近一年使用:0次
2022-04-14更新
|
927次组卷
|
9卷引用:化学-2022年高考考前押题密卷(辽宁卷)
(已下线)化学-2022年高考考前押题密卷(辽宁卷)安徽省黄山市2022届高三第二次质量检测理科综合化学试题(已下线)专项11 电化学基础-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(广东卷)河南省驻马店市2021-2022学年高二下学期期末考试化学试题湖南省常德市石门县第一中学2022届高三下学期月考化学试题湖南省娄底市新化县第一中学2023届高三第七次月考化学试题湖南省株洲市第一中学2023届高三第七次月考化学试题(已下线)回归教材重难点07 重温“两池”原理-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
名校
解题方法
2 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式_______________________ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
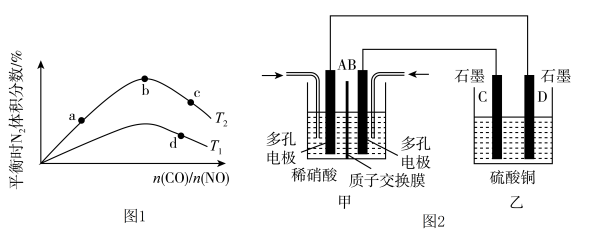
①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为_____________________ ;
③a、c、d三点的平衡常数从大到小的顺序为_________________ 。
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为________ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为___________________ 。
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为________________________ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4- )=c(C2O42- ),则此时溶液呈________ (填“酸性”“碱性”或“中性”)。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③a、c、d三点的平衡常数从大到小的顺序为
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
3 . 某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________ 极;实验过程中,SO42-____________ (填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________ ;检验y极反应产物的方法是________________ 。
(3)Cu极的电极反应式为____________ 。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________ 。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________ g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________ 。

请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为
(2)反应初期,y极的电极反应现象为
(3)Cu极的电极反应式为
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为
您最近一年使用:0次
2020-01-02更新
|
229次组卷
|
2卷引用:辽宁省丹东市2018-2019学年高一上学期期末质量监测化学试题
名校
4 . 某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
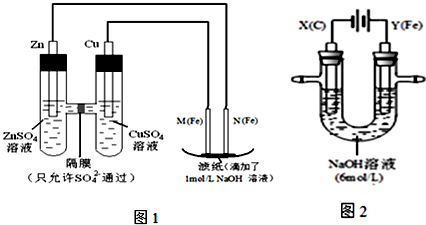
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______ (填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________ .
(3)实验过程中,SO42-______ (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________ .
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______ (填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________ 和4OH- - 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______ g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________ .

请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
(3)实验过程中,SO42-
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为
您最近一年使用:0次
2017-06-17更新
|
606次组卷
|
7卷引用:辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题
辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题(已下线)2014届高考化学二轮专题复习 电化学练习卷(已下线)2014高考名师推荐化学电解规律及电化学计算北京市2017届高三高考押题卷化学试题河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题2020届高考化学二轮复习大题精准训练 ——原电池、电解池填空题
名校
解题方法
5 . 完成下列问题.
(1)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂 可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示.
可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示.__________ .若使用铅蓄电池为该装置充电,产生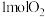 ,则铅蓄电池的正极质量
,则铅蓄电池的正极质量__________ (填“增加”或“减少”)__________ g.若使用甲醇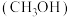 燃料电池(电解质溶液为
燃料电池(电解质溶液为 )为该装置充电,写出负极的电极反应
)为该装置充电,写出负极的电极反应__________ .
②根据图像,试分析下列说法正确的是:__________
A.放电时, 电极周围碱性减弱
电极周围碱性减弱
B.使用 催化剂,中间产物更不稳定
催化剂,中间产物更不稳定
C.放电时每消耗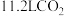 转移
转移 个电子
个电子
D. 是副产物,选择合适的催化剂可以减少其生成
是副产物,选择合适的催化剂可以减少其生成
(2)某学习小组设想利用A装置电解制备绿色硝化剂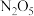 ,装置如下(c、d为惰性电极).
,装置如下(c、d为惰性电极). 一极的电极反应式为
一极的电极反应式为_______________________________________ ;
②在化工生产过程中,常用 将
将 氧化,
氧化, 被还原为S.已知:
被还原为S.已知:
a.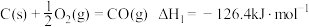
b.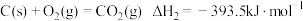
c.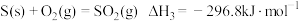
则 氧化
氧化 的热化学方程式为
的热化学方程式为________________________________________ 。
(1)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂
 可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示.
可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示.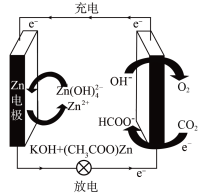

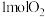 ,则铅蓄电池的正极质量
,则铅蓄电池的正极质量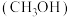 燃料电池(电解质溶液为
燃料电池(电解质溶液为 )为该装置充电,写出负极的电极反应
)为该装置充电,写出负极的电极反应②根据图像,试分析下列说法正确的是:
A.放电时,
 电极周围碱性减弱
电极周围碱性减弱B.使用
 催化剂,中间产物更不稳定
催化剂,中间产物更不稳定C.放电时每消耗
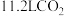 转移
转移 个电子
个电子D.
 是副产物,选择合适的催化剂可以减少其生成
是副产物,选择合适的催化剂可以减少其生成(2)某学习小组设想利用A装置电解制备绿色硝化剂
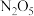 ,装置如下(c、d为惰性电极).
,装置如下(c、d为惰性电极).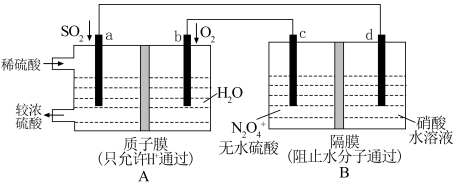
 一极的电极反应式为
一极的电极反应式为②在化工生产过程中,常用
 将
将 氧化,
氧化, 被还原为S.已知:
被还原为S.已知:a.
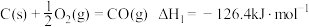
b.
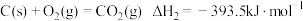
c.
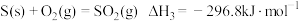
则
 氧化
氧化 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 中科院大连化物所储能技术研究部提出了一种基于 辅助
辅助 放电的混合型液流电池,装置如图所示。下列说法错误的是
放电的混合型液流电池,装置如图所示。下列说法错误的是
 辅助
辅助 放电的混合型液流电池,装置如图所示。下列说法错误的是
放电的混合型液流电池,装置如图所示。下列说法错误的是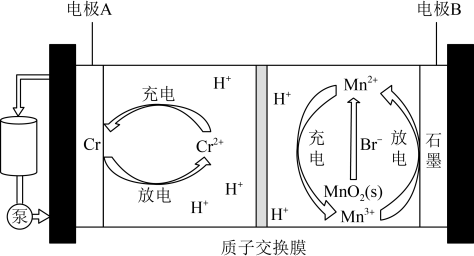
A.充电时, 向电极A迁移 向电极A迁移 |
B.放电时,在该环境下的氧化性: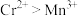 |
C.充电时,电极B上还可能发生: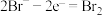 |
D.放电过程中,可利用 及时清除电极B上的“死锰” 及时清除电极B上的“死锰” ,提高充放电过程的可逆性 ,提高充放电过程的可逆性 |
您最近一年使用:0次
2024-05-20更新
|
182次组卷
|
3卷引用:辽宁省协作校2023-2024学年高三下学期三模化学试题
名校
7 . 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
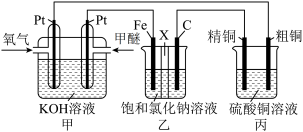

| A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区 |
| B.乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+ |
| C.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
| D.通入氧气的一极为正极,发生的电极反应为O2 - 4e- + 2H2O = 4OH- |
您最近一年使用:0次
2018-01-10更新
|
359次组卷
|
13卷引用:辽宁省葫芦岛市六校协作体2016-2017学年高二上学期期中联考化学试题
辽宁省葫芦岛市六校协作体2016-2017学年高二上学期期中联考化学试题2016届湖北省七市(州)高三下学期3月联合调研理综化学试卷山西省实验中学2018届高三上学期第二次月考化学试题北京市昌平区2018届高三化学12月月考试题(已下线)【中等生百日捷进提升系列-技能方法】专题08 电解池类选择题解题方法和策略重庆市万州第二高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高一下学期第二次考试化学试题河北安平中学2019-2020学年高二上学期第二次月考化学试题山东省实验中学2021届高三上学期第一次诊断考试化学试题山东省济南市莱芜一中2021届高三1月份月考化学试题山东省栖霞市第一中学2021-2022学年高三上学期开学摸底考试化学试题山东省蓬莱第二中学2021-2022学年高三上学期第一次月考化学试题福建省福州市四校联盟2022-2023学年高二下学期期末联考化学试题
11-12高二上·辽宁·期中
解题方法
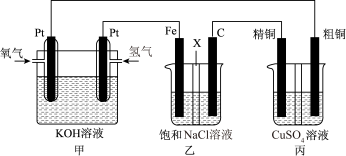
8 . 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氧气的电极为________ (填“正极”或“负极”),负极的电极反应式为______________ 。
(2)铁电极为________ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______________ 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________ 区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将________ (填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为________ ;丙装置中阴极析出铜的质量为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
您最近一年使用:0次
2016-12-09更新
|
161次组卷
|
5卷引用:2011-2012学年辽南协作体高二上学期期中考试化学试卷
(已下线)2011-2012学年辽南协作体高二上学期期中考试化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷河北省鸡泽县第一中学2016-2017学年高一下学期期中考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题



