名校
1 . 氧化和还原是认识物质性质、分析化学变化的重要视角之一,对生产、生活乃至生命活动中有着十分重要的作用。
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。_____
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现_____ (填“氧化性”或“还原性”),I2为_____ (填“氧化产物”或“还原产物”)。
③已知: 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
_____ I-(填“>”或“<”),写出该反应的化学方程式_____ 。
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少
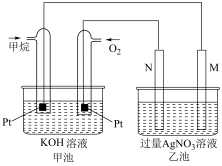
①甲池中通入乙醇的铂电极名称是_____ (选填“正极”、“负极”、“阴极”、“阳极”),通入O2的铂电极反应式为_____ 。
②乙池属于_____ (填“原电池”或“电解池”),工作时,乙池中电子流出的电极是_____ (选填“M”或N”);
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为_____ L(标况下);
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是_____ (选填“粗铜”或“精铜”),反应一段时间以后,电解液溶液的浓度_____ 。(选填“增大”、“减小”“不变”)
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
| A.NH3→NO | B.Fe2O3→Fe |
| C.KClO3→Cl2 | D.H2SO4→SO2 |
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
A.Fe2+、H+、 、 、 |
B.Cu2+、Al3+、 、Cl- 、Cl- |
C.K+、Al3+、OH-、 |
D.Ba2+、Na+、 、ClO- 、ClO- |
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现
③已知:
 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
| A.PbO2是电池的负极 |
| B.Pb是负极 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
| A.防腐原理主要是避免发生反应:2Fe+O2+2H2O=2Fe(OH)2 |
| B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池 |
| C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极 |
| D.钢构件可采用不锈钢材料以减缓电化学腐蚀 |
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

| A.若X为碳棒,开关K置于A处时,铁电极反应2H2O+2e-=H2+2OH- |
| B.若X为碳棒,开关K置于A处可以减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于B处时,铁电极反应为2H++2e-=H2 |
(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少

①甲池中通入乙醇的铂电极名称是
②乙池属于
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是
您最近半年使用:0次
名校
解题方法
2 . 为探究Ag+与Fe3+氧化性的相关问题,甲乙两位同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g、Ag2SO4:0.796g
(1)甲同学的实验如表:
注:经检验黑色固体为Ag
①甲同学得出 氧化性强于
氧化性强于 的依据是
的依据是___ 。
②Ag+氧化Fe2+的离子方程式为:___ 。
(2)乙同学采用如图的电化学装置进行验证。补全电化学装置示意图___ 。
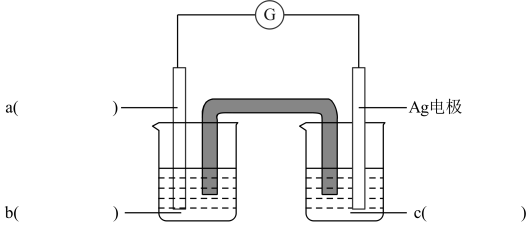
实验中,乙同学发现电流计指针为0后,继续向左侧烧杯中加入___ 溶液,Ag电极溶解,指针反向偏转,说明Ag+氧化Fe2+的反应是可逆反应。
(3)丙同学设计了如下实验测定上述可逆反应的平衡常数K。
实验II:一定温度下,将0.0100mol·L-1Ag2SO4溶液与0.0400mol/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀;
实验III:待实验II中反应达到平衡状态时,取vmL上层清液,用c1mol/LKSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2++(红色) K2=102.3
FeSCN2++(红色) K2=102.3
①滴定过程中Fe3+的作用是____ 。
②测得平衡常数K=____ 。(用含c1,v1,v的代数式表示)
③取实验II的浊液测定c(Ag+),会使所测K值____ (填“偏高”“偏低”或“不受影响”。
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g、Ag2SO4:0.796g
(1)甲同学的实验如表:
| 序号 | 操作 | 现象 |
| 实验I | 将2mL1mol/LAgNO3溶液加入到1mL1mol/LFeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①甲同学得出
 氧化性强于
氧化性强于 的依据是
的依据是②Ag+氧化Fe2+的离子方程式为:
(2)乙同学采用如图的电化学装置进行验证。补全电化学装置示意图

实验中,乙同学发现电流计指针为0后,继续向左侧烧杯中加入
(3)丙同学设计了如下实验测定上述可逆反应的平衡常数K。
实验II:一定温度下,将0.0100mol·L-1Ag2SO4溶液与0.0400mol/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀;
实验III:待实验II中反应达到平衡状态时,取vmL上层清液,用c1mol/LKSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1mL。
资料:Ag++SCN-
 AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012Fe3++SCN-
 FeSCN2++(红色) K2=102.3
FeSCN2++(红色) K2=102.3①滴定过程中Fe3+的作用是
②测得平衡常数K=
③取实验II的浊液测定c(Ag+),会使所测K值
您最近半年使用:0次
解题方法
3 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。请回答下列问题:
(1)KIO3的化学名称是___________ 。
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式: +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,___________ 。
(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是___________ (请用化学反应方程式表示)。
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO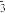 移向
移向___________ (填“石墨I”或“石墨II”);在使用过程中石墨I电极反应生成一种氧化物Y,请写出该氧化物Y的化学式是___________ 。
②请写出装置1中石墨II的电极反应式是___________ 。
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是___________ (填“石墨”或“不锈钢”或“两者皆可”),该电极上发生的电极反应式是___________ 。
④装置2,电解过程中通过离子交换膜的离子主要是___________ ;电解后,b极区周围的pH会___________ (填“升高”或“降低”)。
(1)KIO3的化学名称是
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式:
 +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO
 移向
移向②请写出装置1中石墨II的电极反应式是
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是
④装置2,电解过程中通过离子交换膜的离子主要是
您最近半年使用:0次
4 . 电化学原理有着重要的应用。
(1)探究电化学反应的规律
某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验装置如图所示。
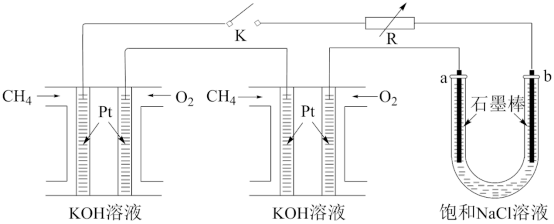
①甲烷燃料电池工作时,负极上通入的气体为____ (填化学式);闭合开关K后a、b电极上均有气体产生,其中a电极上得到的气体为____ (填化学式)。
②若每个电池甲烷通入量均为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为____ L(标准状况)。
(2)探究氧化还原反应的规律
为探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响,设计如图实验。
①实验乙中右边烧杯电极的反应式为____ 。
②已知E为电池电动势【又称理论电压,为两个电极电位之差,即E=E(+)-E(-)】,根据实验可知,甲电池与乙电池相比较,E甲____ E乙(填“>”、“<”或“=”)。
③从氧化还原反应的角度分析,Cl-对反应的影响为____ (填选项字母)。
A.增强了Cu2+的氧化性 B.减弱了Cu2+氧化性
C.增强了HSO 的还原性 D.减弱了HSO
的还原性 D.减弱了HSO 的还原性
的还原性
(1)探究电化学反应的规律
某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验装置如图所示。

①甲烷燃料电池工作时,负极上通入的气体为
②若每个电池甲烷通入量均为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为
(2)探究氧化还原反应的规律
为探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响,设计如图实验。
| 编号 | 甲 | 乙 |
| 实验 |  | 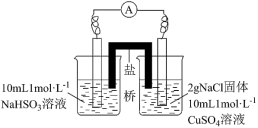 |
| 现象 | 电流计发生较小偏转,3min时无明显现象 | 电流计发生明显偏转,30s时,左边烧杯石墨电极上产生气体;右边烧杯石墨电极上产生白色沉淀(经检验为CuCl) |
①实验乙中右边烧杯电极的反应式为
②已知E为电池电动势【又称理论电压,为两个电极电位之差,即E=E(+)-E(-)】,根据实验可知,甲电池与乙电池相比较,E甲
③从氧化还原反应的角度分析,Cl-对反应的影响为
A.增强了Cu2+的氧化性 B.减弱了Cu2+氧化性
C.增强了HSO
 的还原性 D.减弱了HSO
的还原性 D.减弱了HSO 的还原性
的还原性
您最近半年使用:0次
名校
解题方法
5 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 mol⸱L−1 的AgNO3溶液,乙池为1 mol⸱L−1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是


A.实验开始先断开K1,闭合K2,此时 向B电极移动 向B电极移动 |
| B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
您最近半年使用:0次
名校
解题方法
6 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
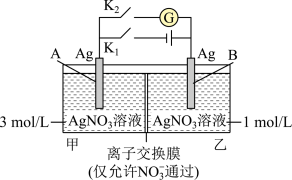

| A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等 |
| B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g |
| C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大 |
您最近半年使用:0次
2020-06-20更新
|
415次组卷
|
2卷引用:河北省石家庄市2020届高中毕业班综合训练(二)理综化学试题
解题方法
7 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是


| A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| B.断开K1、闭合K2,当转移0.1 mol e-时,乙池溶液质量增加17.0 g |
| C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大 |
您最近半年使用:0次
名校
8 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
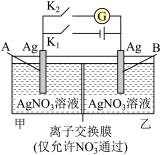

| A.当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加 |
| B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| C.实验开始先断开K1,闭合K2,此时NO3-向B电极移动 |
| D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
您最近半年使用:0次
2019-04-25更新
|
659次组卷
|
2卷引用:【市级联考】山西省运城市2019届高三下学期(4月)高考适应性测试理科综合化学试题
解题方法
9 . 某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
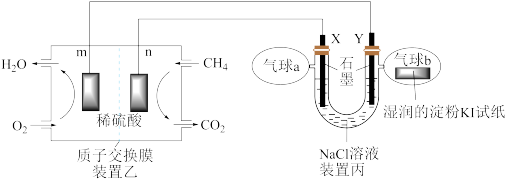
(1)m极为_______ 极,该电极发生的电极反应式为_______
(2)装置丙Y极电极反应式为_______ ;装置乙中n电极发生反应的电极反应式为:_______
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:_______ 。
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为_______  。(保留小数点后两位)
。(保留小数点后两位)
③某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是_______ 。
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
(1)m极为
(2)装置丙Y极电极反应式为
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近半年使用:0次
10 . 高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备 。
。
以石墨、铜为电极,电解 溶液制备
溶液制备 溶液,装置如图所示。
溶液,装置如图所示。

(1)电解过程中,Cu极附近电解质溶液的pH___________ (填“升高”“降低”或“不变”)。阳极的电极反应式为___________ 。
(2)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究 和
和 氧化性强弱。装置如图所示。
氧化性强弱。装置如图所示。
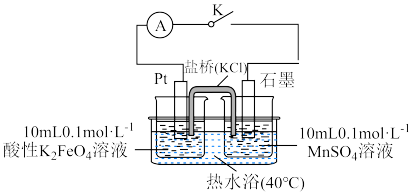
关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(3)关闭K,盐桥中___________ 向左烧杯迁移。盐桥的主要作用是___________ 。
(4)正极反应式为___________ ,实验结论是氧化性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
实验(三):探究影响草酸和酸性 溶液反应的因素(
溶液反应的因素( ,
,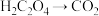 )。
)。
为了探究外界条件改变对反应速率的影响,设计如下实验方案:
(5)通过实验①、②可探究___________ 的改变对反应速率的影响。
(6)在一定 溶液中加入适量硫酸,再加入一定量草酸溶液,产生
溶液中加入适量硫酸,再加入一定量草酸溶液,产生 体积(同温同压)与反应时间的关系如图所示(水浴温度保持35℃)。
体积(同温同压)与反应时间的关系如图所示(水浴温度保持35℃)。
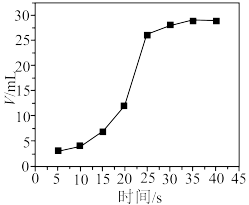
 时间段反应速率突增,其原因可能是
时间段反应速率突增,其原因可能是___________ 。
实验(一):电解法制备
 。
。以石墨、铜为电极,电解
 溶液制备
溶液制备 溶液,装置如图所示。
溶液,装置如图所示。
(1)电解过程中,Cu极附近电解质溶液的pH
(2)铜极、石墨极能否互换并简述理由:
实验(二):探究
 和
和 氧化性强弱。装置如图所示。
氧化性强弱。装置如图所示。
关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(3)关闭K,盐桥中
(4)正极反应式为

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。实验(三):探究影响草酸和酸性
 溶液反应的因素(
溶液反应的因素( ,
,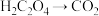 )。
)。为了探究外界条件改变对反应速率的影响,设计如下实验方案:
| 实验 序号 | 实验温度/℃ |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
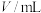 |  | 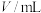 |  | 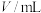 | |||
| ① | 20 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| ② | 20 | 2 | 0.02 | 4 | 0.1 | 6 | 10 |
| ③ | 40 | 2 | 0.02 | 4 | 0.1 | 6 |  |
(5)通过实验①、②可探究
(6)在一定
 溶液中加入适量硫酸,再加入一定量草酸溶液,产生
溶液中加入适量硫酸,再加入一定量草酸溶液,产生 体积(同温同压)与反应时间的关系如图所示(水浴温度保持35℃)。
体积(同温同压)与反应时间的关系如图所示(水浴温度保持35℃)。
 时间段反应速率突增,其原因可能是
时间段反应速率突增,其原因可能是
您最近半年使用:0次



