名校
解题方法
1 . 以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵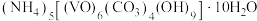 .其过程
.其过程 溶液
溶液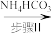 氧钒(Ⅳ)碱式碳酸铵粗产品
氧钒(Ⅳ)碱式碳酸铵粗产品
已知VO2+能被O2氧化,回答下列问题:
(1)步骤Ⅰ的反应装置如右图(夹持及加热装置略去)

①仪器a的名称为___________ ,使用此仪器的优点是_________________________ 。
②步骤Ⅰ生成 的同时,还生成一种无色无污染的气体,该反应的化学方程式为
的同时,还生成一种无色无污染的气体,该反应的化学方程式为_____________________________________ 。
(2)步骤Ⅱ可在如下图装置中进行.
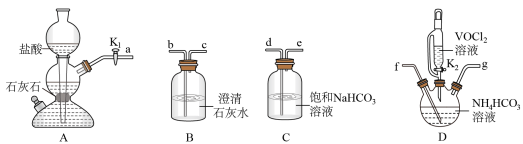
①接口的连接顺序为
___________ 。
②实验开始时,关闭 ,打开
,打开 ,其目的是
,其目的是__________________________ .当___________ 时(写实验现象),再关闭 ,打开
,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。
(3)测定产品纯度
称取 氧钒(Ⅳ)碱式碳酸铵粗产品经处理后,钒(V)元素均以
氧钒(Ⅳ)碱式碳酸铵粗产品经处理后,钒(V)元素均以 的形式存在,然后用
的形式存在,然后用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。
。
(已知: )
)
产品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为 )的质量分数为
)的质量分数为___________ 。
(4)全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色.
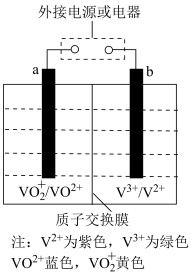
其充电时,阳极的电极方程式为_______________________________________ 。
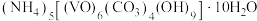 .其过程
.其过程 溶液
溶液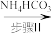 氧钒(Ⅳ)碱式碳酸铵粗产品
氧钒(Ⅳ)碱式碳酸铵粗产品已知VO2+能被O2氧化,回答下列问题:
(1)步骤Ⅰ的反应装置如右图(夹持及加热装置略去)

①仪器a的名称为
②步骤Ⅰ生成
 的同时,还生成一种无色无污染的气体,该反应的化学方程式为
的同时,还生成一种无色无污染的气体,该反应的化学方程式为(2)步骤Ⅱ可在如下图装置中进行.

①接口的连接顺序为

②实验开始时,关闭
 ,打开
,打开 ,其目的是
,其目的是 ,打开
,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。(3)测定产品纯度
称取
 氧钒(Ⅳ)碱式碳酸铵粗产品经处理后,钒(V)元素均以
氧钒(Ⅳ)碱式碳酸铵粗产品经处理后,钒(V)元素均以 的形式存在,然后用
的形式存在,然后用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为 。
。(已知:
 )
)产品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为
 )的质量分数为
)的质量分数为(4)全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色.

其充电时,阳极的电极方程式为
您最近一年使用:0次
2 . 使用可再生能源,如太阳能、潮汐能等产生的电能,通过电化学的方式将二氧化碳转化为高附加值的化学产品,如甲烷、乙烯、乙醇等是一种非常有前景的课题。
请回答下列问题:
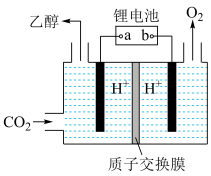
(1)已知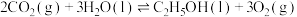
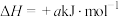 ,则
,则 的摩尔燃烧焓(
的摩尔燃烧焓( )为
)为____________ 。若已知 的摩尔燃烧焓(
的摩尔燃烧焓( )为
)为 ,
, 转化为乙醇的原理为
转化为乙醇的原理为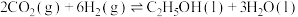

__________  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2)以锂电池为电源,其电池总反应为 ,可将
,可将 转化为乙醇,其原理如图所示,电解池所用电极材料均为惰性电极,每消耗32g
转化为乙醇,其原理如图所示,电解池所用电极材料均为惰性电极,每消耗32g ,理论上会生成标准状况下
,理论上会生成标准状况下 的体积为
的体积为___________ L,装置中产生乙醇的电极反应式为__________________ ,若给锂电池充电,锂电池阳极的电极反应式为__________ 。
(3)若采用乙醇燃料电池作为电源探究氢氧化钾的制备和粗铜的精炼,装置如图所示。

①甲装置中左侧 电极的电极反应式为
电极的电极反应式为___________________ ,若9.2g乙醇参与反应,乙装置中铁电极上产生___________  气体。
气体。
②乙装置中X为阳离子交换膜,已知饱和氯化钾溶液中含有的溶质为1 ,若收集到气体的物质的量之比为3∶2,则乙装置中碳电极上产生气体的质量为
,若收集到气体的物质的量之比为3∶2,则乙装置中碳电极上产生气体的质量为___________ g。
请回答下列问题:
(1)已知
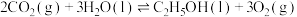
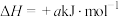 ,则
,则 的摩尔燃烧焓(
的摩尔燃烧焓( )为
)为 的摩尔燃烧焓(
的摩尔燃烧焓( )为
)为 ,
, 转化为乙醇的原理为
转化为乙醇的原理为

 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)以锂电池为电源,其电池总反应为
 ,可将
,可将 转化为乙醇,其原理如图所示,电解池所用电极材料均为惰性电极,每消耗32g
转化为乙醇,其原理如图所示,电解池所用电极材料均为惰性电极,每消耗32g ,理论上会生成标准状况下
,理论上会生成标准状况下 的体积为
的体积为
(3)若采用乙醇燃料电池作为电源探究氢氧化钾的制备和粗铜的精炼,装置如图所示。

①甲装置中左侧
 电极的电极反应式为
电极的电极反应式为 气体。
气体。②乙装置中X为阳离子交换膜,已知饱和氯化钾溶液中含有的溶质为1
 ,若收集到气体的物质的量之比为3∶2,则乙装置中碳电极上产生气体的质量为
,若收集到气体的物质的量之比为3∶2,则乙装置中碳电极上产生气体的质量为
您最近一年使用:0次
3 . 通过电解 、
、 的混合溶液得到普通干电池中的锌与
的混合溶液得到普通干电池中的锌与 ,某研究小组设计了如下图所示的实验探究装置。
,某研究小组设计了如下图所示的实验探究装置。
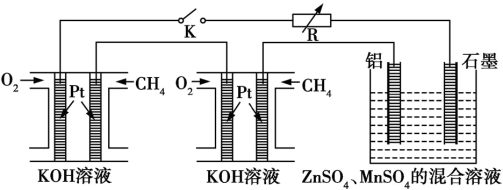
回答下列问题:
(1)燃料电池的优点是_______ ,图中是将两个甲烷燃料电池串联后作为电源,负极的电极反应为_______ 。
(2)闭合开关 后,铝电极上的产物是
后,铝电极上的产物是_______ ,一段时间后阳极附近溶液的pH_______ (填“增大”、“不变”或“减小”),电解 、
、 的混合溶液的阳极反应式为
的混合溶液的阳极反应式为_______
(3)假定燃料电池中的化学能完全转化为电能,负极每消耗2.24L(标况) ,电解池中回收制得
,电解池中回收制得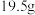 单质
单质 ,电解池的能量利用率为
,电解池的能量利用率为_______ 。
 、
、 的混合溶液得到普通干电池中的锌与
的混合溶液得到普通干电池中的锌与 ,某研究小组设计了如下图所示的实验探究装置。
,某研究小组设计了如下图所示的实验探究装置。
回答下列问题:
(1)燃料电池的优点是
(2)闭合开关
 后,铝电极上的产物是
后,铝电极上的产物是 、
、 的混合溶液的阳极反应式为
的混合溶液的阳极反应式为(3)假定燃料电池中的化学能完全转化为电能,负极每消耗2.24L(标况)
 ,电解池中回收制得
,电解池中回收制得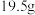 单质
单质 ,电解池的能量利用率为
,电解池的能量利用率为
您最近一年使用:0次
解题方法
4 . 铬及其化合物在工业上用途广泛,工业废水中含有毒的铬(VI),可以利用化学方法处理。
(1)还原法处理
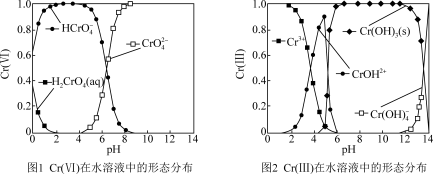
①Cr(VI)在水溶液中的形态分布如图1所示。向pH=2的含Cr(VI)污水中加入NaHSO3,发生的主要反应的离子方程式为_______ 。
②向水体中加入还原剂,将高毒性Cr(VI)还原为低毒性Cr(III),再调节溶液pH范围为_______ Cr(III)生成Cr(OH)3沉淀除去。
(2)电化学法处理
甲醇酸性燃料电池处理酸性含铬废水(主要含有 )的原理如图所示。
)的原理如图所示。
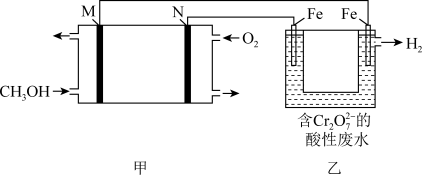
①下列说法正确的是_______ (填标号)
A.M为负极,电极反应为CH3OH+6e-+H2O=6H++CO2↑
B.甲中阴离子向N极移动
C.乙中电极均不参与电极反应
D.乙中阳极区 发生的反应为
发生的反应为 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
②若甲中消耗44.8L氧气(标准状况),则乙中产生_______ molH2(假设阴极只有氢离子放电)。
(3)废水中铬元素含量的测定:准确移取20.00mL含 的酸性废水,向其中加入过量的KI溶液(
的酸性废水,向其中加入过量的KI溶液( +6I-+14H+=2Cr3++3I2+7H2O),充分反应后,以
+6I-+14H+=2Cr3++3I2+7H2O),充分反应后,以_______ 为指示剂,向其中滴加0.0150mol·L-1的Na2S2O3标准溶液(I2+2 =2I-+
=2I-+ ),达到滴定终点时的现象为
),达到滴定终点时的现象为_______ ,重复实验两次,消耗Na2S2O3溶液体积的平均值为VmL。废水中铬元素的浓度为_______ mg·L-1。
(1)还原法处理

①Cr(VI)在水溶液中的形态分布如图1所示。向pH=2的含Cr(VI)污水中加入NaHSO3,发生的主要反应的离子方程式为
②向水体中加入还原剂,将高毒性Cr(VI)还原为低毒性Cr(III),再调节溶液pH范围为
(2)电化学法处理
甲醇酸性燃料电池处理酸性含铬废水(主要含有
 )的原理如图所示。
)的原理如图所示。
①下列说法正确的是
A.M为负极,电极反应为CH3OH+6e-+H2O=6H++CO2↑
B.甲中阴离子向N极移动
C.乙中电极均不参与电极反应
D.乙中阳极区
 发生的反应为
发生的反应为 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O②若甲中消耗44.8L氧气(标准状况),则乙中产生
(3)废水中铬元素含量的测定:准确移取20.00mL含
 的酸性废水,向其中加入过量的KI溶液(
的酸性废水,向其中加入过量的KI溶液( +6I-+14H+=2Cr3++3I2+7H2O),充分反应后,以
+6I-+14H+=2Cr3++3I2+7H2O),充分反应后,以 =2I-+
=2I-+ ),达到滴定终点时的现象为
),达到滴定终点时的现象为
您最近一年使用:0次
名校
解题方法
5 . 用如下装置进行实验:
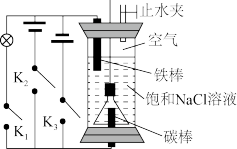
(1)关闭上端止水夹,接通K1,一段时间后用压强传感器测得装置上部压强减小,铁棒表面出现锈迹。则铁棒主要发生,_______ 腐蚀(填“析氢”或“吸氧”);此时碳棒上的电极反应式为:_______ 。
(2)Na2FeO4是一种新型净水剂,可以通过以下反应制备:Fe(OH)2+2Cl2+6NaOH=Na2FeO4+4NaCl+4H2O,为制得Na2FeO4,用一支倒扣的漏斗罩住碳极,如图,首先打开止水夹,断开K1、K2,接通K3。几分钟后,漏斗中产生的气体是_______ ;此时发生的总反应化学方程式为:_______ 。
(3)断开K1、K3,接通K2。阳极的电极反应式为_______ 。打开漏斗上口软塞,发生(2)中反应生成Na2FeO4。
(4)Na2FeO4有强氧化性可用于杀菌消毒,还可净水,其净水的原理是_______ 。

(1)关闭上端止水夹,接通K1,一段时间后用压强传感器测得装置上部压强减小,铁棒表面出现锈迹。则铁棒主要发生,
(2)Na2FeO4是一种新型净水剂,可以通过以下反应制备:Fe(OH)2+2Cl2+6NaOH=Na2FeO4+4NaCl+4H2O,为制得Na2FeO4,用一支倒扣的漏斗罩住碳极,如图,首先打开止水夹,断开K1、K2,接通K3。几分钟后,漏斗中产生的气体是
(3)断开K1、K3,接通K2。阳极的电极反应式为
(4)Na2FeO4有强氧化性可用于杀菌消毒,还可净水,其净水的原理是
您最近一年使用:0次
名校
解题方法
6 . 电化学是当今化学研究的热点之一,回答下列问题:
(1)碱性电池具有耐用、电流量大,储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:
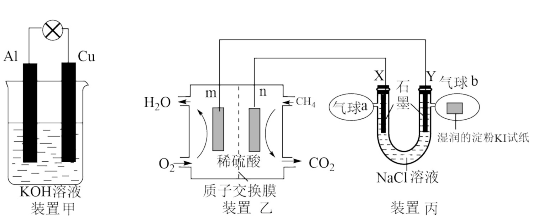
①在_______ (“ ”或“
”或“ ”)极有
”)极有 生成,
生成, 极电极反应式为
极电极反应式为_______
②若有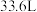 (标准状况下)
(标准状况下) 生成,则理论上电解质溶液增重
生成,则理论上电解质溶液增重_______ g。
(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
①m极为_______ 极,装置乙发生反应的化学方程式为_______
②Y极电极反应式为_______
③气球b中的现象为_______ ,证明了氯气的化学性质之一:_______ 性。
(1)碱性电池具有耐用、电流量大,储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:

①在
 ”或“
”或“ ”)极有
”)极有 生成,
生成, 极电极反应式为
极电极反应式为②若有
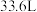 (标准状况下)
(标准状况下) 生成,则理论上电解质溶液增重
生成,则理论上电解质溶液增重(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解
 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。①m极为
②Y极电极反应式为
③气球b中的现象为
您最近一年使用:0次
2022-04-04更新
|
299次组卷
|
2卷引用:安徽省合肥市第八中学2021-2022学年高二上学期期末考试化学试题
解题方法
7 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
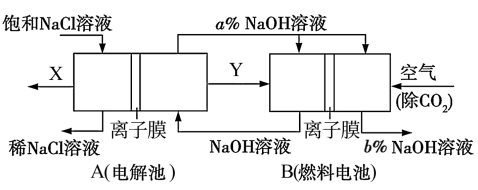
请回答下列问题:
(1)A池总反应的离子反应方程式为___________ 。燃料电池B中正极上发生的电极反应式为___________ 。
(2)装置中的离子膜是阳离子交换膜,当阴极产生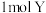 时,通过离子交换膜的
时,通过离子交换膜的 有
有___________  。
。
(3)装置图中氢氧化钠溶液质量分数的大小:
___________ 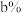 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
请回答下列问题:
(1)A池总反应的离子反应方程式为
(2)装置中的离子膜是阳离子交换膜,当阴极产生
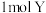 时,通过离子交换膜的
时,通过离子交换膜的 有
有 。
。(3)装置图中氢氧化钠溶液质量分数的大小:

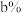 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
您最近一年使用:0次
解题方法
8 . 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择___________ (填字母),
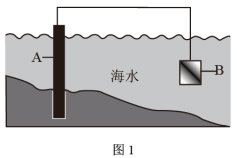
a.碳棒 b.锌板 c.铜板 d.铝镁合金
这种电化学防腐方法称为___________ 。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
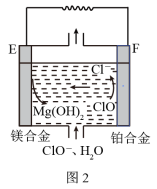
①E为该燃料电池的___________ 极,F电极上的电极反应式为___________ 。
②常温下,若用该燃料电池电解500mL饱和食盐水,当产生标准状况下1120mL气体时,溶液的pH为___________ 。(忽略电解前后溶液体积的变化)
③燃料电池应用前景广阔,主要优点有___________ (答出两点即可)。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

a.碳棒 b.锌板 c.铜板 d.铝镁合金
这种电化学防腐方法称为
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

①E为该燃料电池的
②常温下,若用该燃料电池电解500mL饱和食盐水,当产生标准状况下1120mL气体时,溶液的pH为
③燃料电池应用前景广阔,主要优点有
您最近一年使用:0次
2022-01-01更新
|
189次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021-2022学年高二上学期期末考试(普通班)化学试题
名校
9 . 应用电化学原理,回答下列问题。
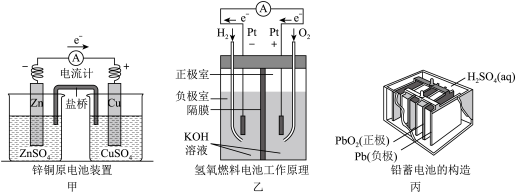
(1)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是_______ 。
(2)乙中正极反应式为_______ ,若将H2换成CH4,则负极反应式为_______ 。
(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池_______ 极相连接。充电时该电极反应式_______ 。
(4)若用铅蓄电池作为电源电解硝酸银溶液500毫升,电路中转移0.2 mol电子,则溶液中氢离子浓度_______ (忽略溶液体积变化)。

(1)甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是
(2)乙中正极反应式为
(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(4)若用铅蓄电池作为电源电解硝酸银溶液500毫升,电路中转移0.2 mol电子,则溶液中氢离子浓度
您最近一年使用:0次
解题方法
10 . 如图是原电池电解池的组合装置图。
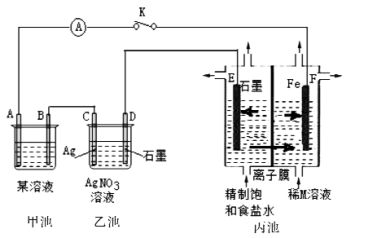
请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为______ (填“原电池”或“电解池”);B电极上发生的现象为______ 。
②乙池中的银电极上的电极反应式为______ 。
③丙池中E电极为______ (填“正极”、“负极”、“阴极”或“阳极”);闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是______ (填化学式);丙池中的离子膜为______ (填“阳离子交换膜”或“阴离子交换膜”)
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为______ 。
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气。则:
①A电极的反应方程式为______ 。
②若线路中转移0.02mol电子,乙池中D极质量变化______ g。
③二氧化氯(ClO2)为黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出也能用丙池装置制取二氧化氯。写出生成二氧化氯的电极反应式为______ 。

请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为
②乙池中的银电极上的电极反应式为
③丙池中E电极为
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气。则:
①A电极的反应方程式为
②若线路中转移0.02mol电子,乙池中D极质量变化
③二氧化氯(ClO2)为黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出也能用丙池装置制取二氧化氯。写出生成二氧化氯的电极反应式为
您最近一年使用:0次
2021-01-28更新
|
297次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021-2022学年高二(普通班)下学期开学摸底考试化学试题



