名校
解题方法
1 . 本次亚运会火炬燃料甲醇是利用焦炉气中的氢气(H2)与从工业尾气中捕集的二氧化碳(CO2)合成,并由远程甲醇动力重卡提供运输保障。
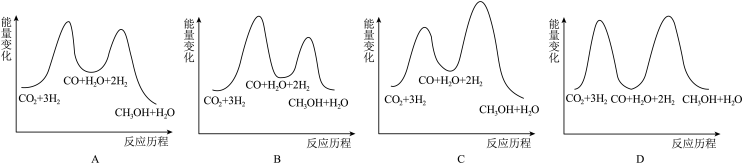
Ⅰ.二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2(g)=CH2OH(g) + H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g) +H2(g)=CO(g) + H2O(g) ΔH1 = +41 kJ·mol-1
②CO (g) + 2H2(g)=CH3OH(g) ΔH2 = -90 kJ·mol-1
(1)总反应的 ΔH=___________ kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
(2)甲醇可作为燃料使用,也可用CH3OH 和O2组合形成质子交换膜燃料电池,其结构示意图如图所示:
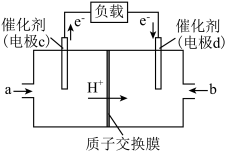
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极的反应方程式___________
②下图是一个电化学过程的装置示意图。 已知甲池的总反应式为 2CH3OH+3O2+4KOH=2K2CO3+6H2O
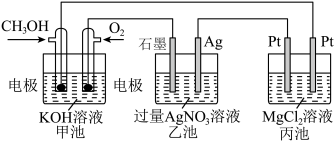
a.甲池是___________ (填“原电池”或“电解池”),通入O2的电极作___________ 极;
b.乙池是___________ (填“原电池”或“电解池”),石墨电极为___________ 极, 电极反应式为___________ 。乙池中总反应的离子方程式为___________ 。一段时间后丙池___________ 极(填“阴极”或“阳极”)附近有白色浑浊出现。
c. 当乙池中Ag极的质量增加5.40 g时, 甲池中理论上消耗O₂___________ mL(标准状况)。
(3)回收并利用CO₂一直是科研人员研究的热点。2021年,中科院天津工业生物技术研究所成果“无细胞化学酶系统催化CO₂合成淀粉”在国际学术期刊《自然》上发表。其中一步核心反应如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是

(4)利用两种金属催化剂,在水溶液体系中将CO2分别转化为CO和 HCOOH的反应过程示意图如图:

下列说法正确的是___________
(5)CO用于处理大气污染物 N2O 的反应为 CO(g)+N2O(g)=CO2(g)+N2(g)。在Zn⁺作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。


总反应:CO(g)+N2O(g)=CO2(g)+N2(g) ΔH=______ kJ/mol;该总反应的决速步是反应___________ (填“①”或“②”)。
Ⅰ.二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2(g)=CH2OH(g) + H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g) +H2(g)=CO(g) + H2O(g) ΔH1 = +41 kJ·mol-1
②CO (g) + 2H2(g)=CH3OH(g) ΔH2 = -90 kJ·mol-1
(1)总反应的 ΔH=

(2)甲醇可作为燃料使用,也可用CH3OH 和O2组合形成质子交换膜燃料电池,其结构示意图如图所示:

①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极的反应方程式
②下图是一个电化学过程的装置示意图。 已知甲池的总反应式为 2CH3OH+3O2+4KOH=2K2CO3+6H2O

a.甲池是
b.乙池是
c. 当乙池中Ag极的质量增加5.40 g时, 甲池中理论上消耗O₂
(3)回收并利用CO₂一直是科研人员研究的热点。2021年,中科院天津工业生物技术研究所成果“无细胞化学酶系统催化CO₂合成淀粉”在国际学术期刊《自然》上发表。其中一步核心反应如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是

| A.反应①中消耗44gCO2, 转移电子数为6NA |
| B.反应③中 cat为催化剂,实验室常用MnO2催化该反应 |
| C.30g HCHO与DHA 的混合物中所含氧原子数为2 NA |
| D.淀粉与纤维素的分子式相同,但不互为同分异构体 |

下列说法正确的是___________
| A.在转化为CO 的路径中,只涉及碳氧键的断裂和氧氢键的形成 |
| B.在转化为HCOOH的路径中,CO2被氧化为HCOOH |
| C.两个转化路径均有非极性键的形成 |
| D.上述反应过程说明催化剂具有选择性 |


总反应:CO(g)+N2O(g)=CO2(g)+N2(g) ΔH=
您最近半年使用:0次
名校
解题方法
2 . 回答下列小题
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
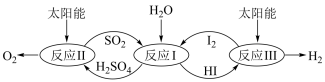
相关反应的热化学方程式为:
反应Ⅰ: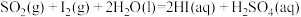
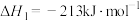
反应Ⅱ: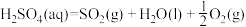
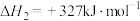
反应Ⅲ: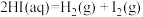
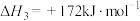
①总反应的热化学方程式为: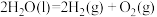

________ 。
②在该过程中 和
和________ 对总反应起到催化剂作用;使用了催化剂,总反应的
________ (填“增大”“减小”或“不变”)。
(2) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极上的反应式:________ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 体积比为
体积比为________ 。
(3) 法可用于水体中有机污染物降解,其反应机理如图所示。
法可用于水体中有机污染物降解,其反应机理如图所示。
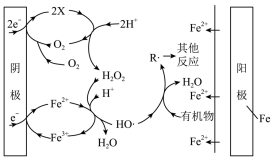
阴极发生两个不同的电极反应,其中之一产物为X。X微粒的化学式为________ ;
阴极附近 参与反应的离子方程式为
参与反应的离子方程式为________ 。
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。

相关反应的热化学方程式为:
反应Ⅰ:
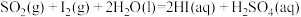
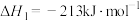
反应Ⅱ:
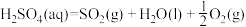
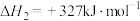
反应Ⅲ:
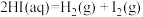
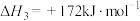
①总反应的热化学方程式为:
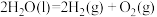

②在该过程中
 和
和
(2)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极上的反应式:
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 体积比为
体积比为(3)
 法可用于水体中有机污染物降解,其反应机理如图所示。
法可用于水体中有机污染物降解,其反应机理如图所示。
阴极发生两个不同的电极反应,其中之一产物为X。X微粒的化学式为
阴极附近
 参与反应的离子方程式为
参与反应的离子方程式为
您最近半年使用:0次
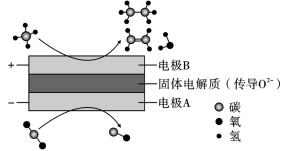
3 . 甲醇 又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
(1)工业上可利用 和
和 生产甲醇,方程式如下:
生产甲醇,方程式如下:


又查资料得知:①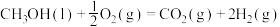
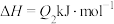
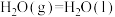
 ,则表示甲醇标准燃烧热的热化学方程式为
,则表示甲醇标准燃烧热的热化学方程式为__________________ 。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为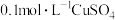 溶液(假设反应前后溶液体积不变),当向甲池通入物质
溶液(假设反应前后溶液体积不变),当向甲池通入物质 和
和 时,
时, 极附近呈红色。
极附近呈红色。

①物质 的化学式为
的化学式为______ , 电极的电极反应式为
电极的电极反应式为____________ 。
②乙装置中D电极方程式为__________________ 。
③丙装置中总反应的离子方程式为__________________ 。
④当乙装置中 电极收集到
电极收集到 (标况下)气体时,丙中溶液的
(标况下)气体时,丙中溶液的
______  。
。
 又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。(1)工业上可利用
 和
和 生产甲醇,方程式如下:
生产甲醇,方程式如下:

又查资料得知:①
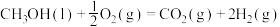
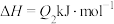
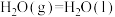
 ,则表示甲醇标准燃烧热的热化学方程式为
,则表示甲醇标准燃烧热的热化学方程式为(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为
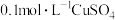 溶液(假设反应前后溶液体积不变),当向甲池通入物质
溶液(假设反应前后溶液体积不变),当向甲池通入物质 和
和 时,
时, 极附近呈红色。
极附近呈红色。
①物质
 的化学式为
的化学式为 电极的电极反应式为
电极的电极反应式为②乙装置中D电极方程式为
③丙装置中总反应的离子方程式为
④当乙装置中
 电极收集到
电极收集到 (标况下)气体时,丙中溶液的
(标况下)气体时,丙中溶液的
 。
。
您最近半年使用:0次
2023-10-20更新
|
128次组卷
|
2卷引用:江苏省常熟中学2023-2024学年高二上学期10月阶段性学业水平调研化学试题
名校
4 . 研究电化学原理与应用有非常重要的意义。
(1)与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是_______ (回答一条即可)。 可作超级电容器材料。用惰性电极电解
可作超级电容器材料。用惰性电极电解 溶液制得
溶液制得 ,其阳极的电极反应式为
,其阳极的电极反应式为_______ 。
(2)铅蓄电池是最常见的二次电池 。
。
①电池正极电极反应式_______ ,充电时阴极反应为_______ 。
②铅蓄电池为电源进行电解精制饱和食盐水制取氯气、氢气、烧碱和氯的含氧酸盐等一系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。试回答下列问题:
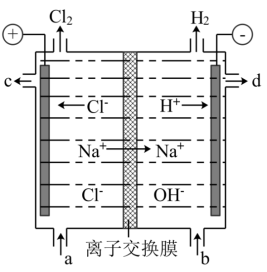
电解精制饱和食盐水的化学方程式_______ 。氢氧化钠溶液从图中_______ (填“a”“b”“c”或“d”,下同)处收集。当铅蓄电池电路中有0.5mol电子转移时,可制取氯气标准状况下的体积为_______ L(假设产物无损耗)。
(3)图甲是一种将废水中的氯乙烯(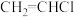 )转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
)转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
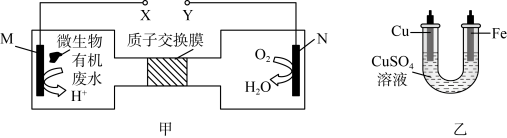
①M为_______ (填写“正极、负极、阴极、阳极”),镀铜时,_______ (填写X或Y)与铁电极相连,工作过程中,N极区域溶液中pH将_______ (填写增大、减小、不变)
②若M极消耗0.1mol氯乙烯,则铁电极增重_______ g,硫酸铜溶液的浓度将_______ (填写“增大、减小、不变”)
(1)与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是
 可作超级电容器材料。用惰性电极电解
可作超级电容器材料。用惰性电极电解 溶液制得
溶液制得 ,其阳极的电极反应式为
,其阳极的电极反应式为(2)铅蓄电池是最常见的二次电池
 。
。①电池正极电极反应式
②铅蓄电池为电源进行电解精制饱和食盐水制取氯气、氢气、烧碱和氯的含氧酸盐等一系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。试回答下列问题:

电解精制饱和食盐水的化学方程式
(3)图甲是一种将废水中的氯乙烯(
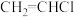 )转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
)转换成对环境无害的微生物电池装置,同时利用此装置在铁上镀铜。
①M为
②若M极消耗0.1mol氯乙烯,则铁电极增重
您最近半年使用:0次
解题方法
5 . 回答下列问题:
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:_______ 。
②已知H2O(l)=H2O(g) ΔH=44kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是_______ kJ。
③上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_______ 。
(2)如图所示,某研究性学习小组利用上述氧化还原反应原理设计一个肼(N2H4)-空气燃料电池(如图甲)并探究某些工业原理。
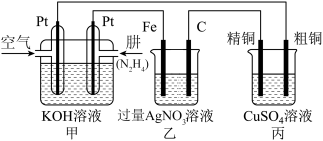
根据要求回答相关问题:
①甲装置中正极的电极反应式为_______ 。
②乙装置中Fe电极的电极反应式为_______ 。电解一段时间后,乙装置中的溶液呈_______ 性。
③图中用丙装置模拟工业中的_______ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中消耗肼的质量为_______ g。
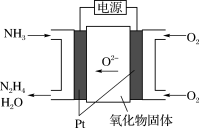
(3)工业上利用N2和H2合成NH3,NH3又可以进一步制备肼(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为_______ 。有学者探究用电解法制备,装置如图所示,试写出其阳极的电极反应式:_______ 。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②已知H2O(l)=H2O(g) ΔH=44kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
③上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(2)如图所示,某研究性学习小组利用上述氧化还原反应原理设计一个肼(N2H4)-空气燃料电池(如图甲)并探究某些工业原理。

根据要求回答相关问题:
①甲装置中正极的电极反应式为
②乙装置中Fe电极的电极反应式为
③图中用丙装置模拟工业中的
(3)工业上利用N2和H2合成NH3,NH3又可以进一步制备肼(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为

您最近半年使用:0次
名校
解题方法
6 . 汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境。
(1)①已知:6g碳完全被氧气氧化放出197kJ的热量,则该反应的热化学方程式可表示为:___________ 。
②
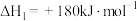

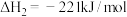
则反应

___________ 。
(2)运用电化学方法可以进行NO的消除和CO含量检测。
①用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示。A电极为___________ 极,电极反应式为___________ 。当O2消耗1.12L(标准状况下),电路中理论上过的电子数目为___________ 。

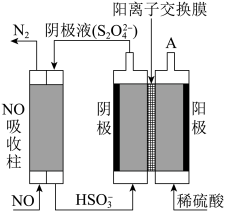
②间接电解法除NO。其原理如图所示,从A中出来的气体是___________ ,电解池阴极的电极反应式___________ 。用离子方程式表示吸收柱中除去NO的原理___________ 。
(1)①已知:6g碳完全被氧气氧化放出197kJ的热量,则该反应的热化学方程式可表示为:
②

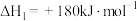

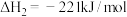
则反应


(2)运用电化学方法可以进行NO的消除和CO含量检测。
①用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示。A电极为

②间接电解法除NO。其原理如图所示,从A中出来的气体是

您最近半年使用:0次
名校
解题方法
7 . 甲醇是一种可再生能源,用途广泛。请回答下列问题:
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为________ 。
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
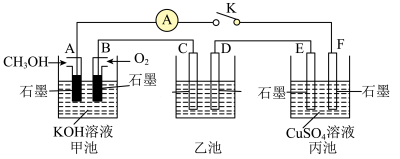
①A电极的电极反应式为________ ,C电极的电势________ (填“低于”或“高于”)D电极的电势。
②若在乙池中实现铁表面镀银,则D电极材料为________ ,乙池中的溶液为________ 。
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入________ (填字母)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是________ 。
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

①A电极的电极反应式为
②若在乙池中实现铁表面镀银,则D电极材料为
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是
您最近半年使用:0次
名校
解题方法
8 . 请回答下列问题:
(1)工业上以 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。
反应分两步:i. 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
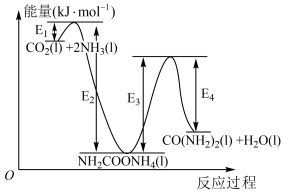
结合反应过程中能量变化示意图,合成尿素总反应的 为
为___________ 。(用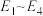 列式表示)
列式表示)
(2)根据表格计算

___________ 。
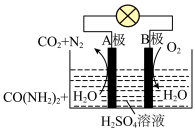
(3)尿素 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为___________ 。
(4)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
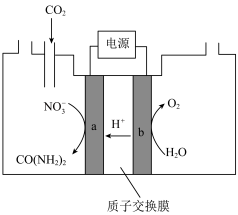
①电极b是电解池的___________ 极。
②尿素分子中,C元素的价态为___________ 。电解过程中生成尿素的电极反应为___________ 。
(5)以石墨为阳极、铁为阴极电解含 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。

①0~1 min时,阴极发生的主要电极反应方程式为___________ 。
②若向废水中加入一定量的NaCl,则电解后的废水中 几乎完全转化为
几乎完全转化为 ,原因是
,原因是___________ 。
(1)工业上以
 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。反应分两步:i.
 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,合成尿素总反应的
 为
为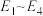 列式表示)
列式表示)(2)根据表格计算
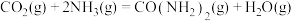

| 化学键 |  |  |  |  |
键能( ) ) | 389 | 728 | 305 | 464 |
(3)尿素
 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
(4)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②尿素分子中,C元素的价态为
(5)以石墨为阳极、铁为阴极电解含
 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
①0~1 min时,阴极发生的主要电极反应方程式为
②若向废水中加入一定量的NaCl,则电解后的废水中
 几乎完全转化为
几乎完全转化为 ,原因是
,原因是
您最近半年使用:0次
解题方法
9 . 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:
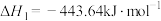

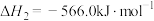
(1)试写出 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
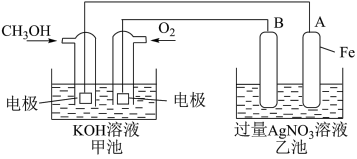
①放电时,甲醇在___________ (填“正”或“负”)极发生反应,电极反应为___________ 。
②工作时,B极的电极反应式为___________ ,A极的电极反应式为___________ 。
(3)某同学设计了一种用电解法制取 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。

已知:

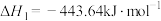

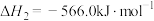
(1)试写出
 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:

①放电时,甲醇在
②工作时,B极的电极反应式为
(3)某同学设计了一种用电解法制取
 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
| A.a为电源正极,b为电源负极 | B.可以用NaCl溶液作为电解质溶液 |
| C.A、B两端都必须用铁作电极 | D.阴极发生的反应为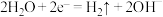 |
您最近半年使用:0次
解题方法
10 . 化学能与电能的相互转化具有较大的社会应用价值。
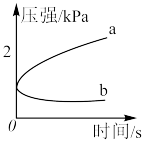
(1)不同浓度酸性介质中,金属腐蚀原理并不相同。密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程如图所示。图中代表pH=2的曲线是___________ (填“a”或“b”)。
(2)缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)2]是常用自来水(pH范围:6.5~8.8)介质碳钢缓蚀剂。钼酸钠(Na2MoO4)在电极表面被还原为MoO2,形成保护膜,减缓腐蚀,该电极的电极反应式为___________ ;同时, 能与
能与 反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出
反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(3)在如图所示的装置中,电极b用金属M制成,a、c、d均为石墨电极,接通电源,金属M沉积在b电极上,同时a、d电极上产生气泡。
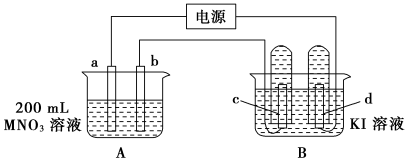
①a电极为___________ 极,电解开始时,在B烧杯的中央滴几滴淀粉溶液,能观察到的现象是___________ 。
②电解进行一段时间后,罩在c电极上的试管也收集到了气体,此时c极上的电极反应式为___________ 。
③当d电极上收集到44.8mL(标准状况)气体时停止电解,a电极上放出了___________ mol气体。
④电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入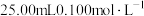 HCl溶液中生成MCl沉淀,当加入31.25mL溶液时刚好沉淀完全。则电解前A烧杯中MNO3溶液的物质的量浓度为
HCl溶液中生成MCl沉淀,当加入31.25mL溶液时刚好沉淀完全。则电解前A烧杯中MNO3溶液的物质的量浓度为___________ 。
(1)不同浓度酸性介质中,金属腐蚀原理并不相同。密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程如图所示。图中代表pH=2的曲线是

(2)缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)2]是常用自来水(pH范围:6.5~8.8)介质碳钢缓蚀剂。钼酸钠(Na2MoO4)在电极表面被还原为MoO2,形成保护膜,减缓腐蚀,该电极的电极反应式为
 能与
能与 反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出
反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出 与
与 反应的离子方程式:
反应的离子方程式:(3)在如图所示的装置中,电极b用金属M制成,a、c、d均为石墨电极,接通电源,金属M沉积在b电极上,同时a、d电极上产生气泡。

①a电极为
②电解进行一段时间后,罩在c电极上的试管也收集到了气体,此时c极上的电极反应式为
③当d电极上收集到44.8mL(标准状况)气体时停止电解,a电极上放出了
④电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入
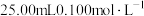 HCl溶液中生成MCl沉淀,当加入31.25mL溶液时刚好沉淀完全。则电解前A烧杯中MNO3溶液的物质的量浓度为
HCl溶液中生成MCl沉淀,当加入31.25mL溶液时刚好沉淀完全。则电解前A烧杯中MNO3溶液的物质的量浓度为
您最近半年使用:0次



