名校
1 . 如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是
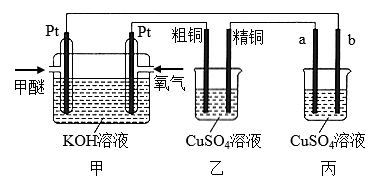

| A.一段时间后,甲装置中溶液 pH升高 |
| B.电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变 |
C.通入氧气的一极为正极,发生的电极反应为 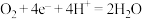 |
| D.丙装置中实现铁片上镀铜,b 应为铁片 |
您最近一年使用:0次
2021-03-04更新
|
995次组卷
|
7卷引用:小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)考向20 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点微专题广东省梅州市2021届高三一模化学试卷广东省梅州市2021届高三下学期3月总复习质检化学试题陕西省渭南市大荔县2020-2021学年高二下学期期末考试化学试题巩固训练8湖南省郴州市桂阳县第一中学 2021-2022 学年高三下学期期中考试试题
名校
解题方法
2 . 某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。以下说法中正确的是


| A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O |
| B.该电池可以用水溶液作电解质溶液 |
| C.放电时,Fe作电池的负极,Fe2O3作电池的正极 |
| D.充电时,Fe作阴极,电池被磁铁吸引 |
您最近一年使用:0次
2021-03-01更新
|
383次组卷
|
3卷引用:小题18 可充电电池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题18 可充电电池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)广东省广州市中山大学附属中学2021届高三下学期3月月考化学试题福建省福州第一中学2020届高三第二次测试理综化学试题
名校
3 . 以CH4、O2、熔融Na2CO3组成的燃料电池电解制备N2O5,装置如图所示,右侧池中隔膜仅允许H+通过。下列说法错误的是


A.石墨1上的电极反应式为CH4+4 -8e-=5CO2+2H2O -8e-=5CO2+2H2O |
| B.右侧池中H+由Pt1极通过隔膜移向Pt2极 |
| C.Pt1极上的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+ |
| D.每制得1 mol N2O5,理论上消耗O2 11.2 L(标准状况下) |
您最近一年使用:0次
2021-02-11更新
|
470次组卷
|
3卷引用:专题09 电化学基础-备战2021届高考化学二轮复习题型专练
(已下线)专题09 电化学基础-备战2021届高考化学二轮复习题型专练福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
名校
解题方法
4 . 电化学知识在生产、科技研究中应用广泛。
(1)可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。

①K 与 M 连接时钢铁桥墩的电化学防护方法为______ 。
②K与N连接时,钢铁桥墩为______ 极(填"正"、"负"、"阴"或"阳"),电极反应式为______ 。
(2) 燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
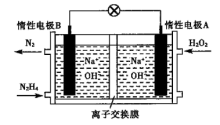
电池工作时,A极区 NaOH浓度不变,则离子交换膜为______ (填"阳离子交换膜"或"阴离子交换膜");电极 B的电极反应式为______ ;电池工作时参加反应的 =
=______ 。
(1)可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。

①K 与 M 连接时钢铁桥墩的电化学防护方法为
②K与N连接时,钢铁桥墩为
(2)
 燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
电池工作时,A极区 NaOH浓度不变,则离子交换膜为
 =
=
您最近一年使用:0次
2021-02-01更新
|
293次组卷
|
3卷引用:第四章第四节 金属的电化学腐蚀与防护(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)
(已下线)第四章第四节 金属的电化学腐蚀与防护(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)山东省聊城市2020-2021学年高二上学期期末考试化学试题四川省成都市大弯中学校2022届高三9月月考化学试题
名校
解题方法
5 . 某单液电池如图所示,其反应原理为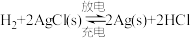 。下列说法错误的是
。下列说法错误的是

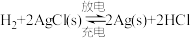 。下列说法错误的是
。下列说法错误的是
| A.放电时,左边电极为负极 |
B.放电时,溶液中 向右边电极移动 向右边电极移动 |
C.充电时,右边电极上发生的电极反应式: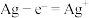 |
D.充电时,当左边电极生成 时,电解质溶液减轻2g 时,电解质溶液减轻2g |
您最近一年使用:0次
2021-01-25更新
|
1448次组卷
|
7卷引用:热点9 化学能与电能-2021年高考化学【热点·重点·难点】专练(新高考)
(已下线)热点9 化学能与电能-2021年高考化学【热点·重点·难点】专练(新高考)湖南省2021年普通高中学业水平选择考适应性测试化学试题(已下线)专题11 电化学-2022年高考化学二轮复习重点专题常考点突破练(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题(已下线)第3讲 原电池 化学电源湖南省湘潭市第二中学2022届高三下学期4月月考化学试题河北省石家庄市河北正中实验中学2022-2023学年高二上学期10月月考化学试题
解题方法
6 . 我国科学家最近发明了一种 电池,电解质为
电池,电解质为 、
、 和
和 ,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
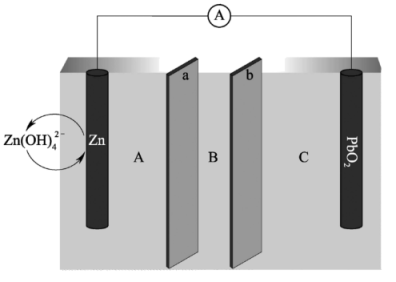
回答下列问题:
(1)电池中, 为
为______ 极,B区域的电解质为______ (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(2)电池反应的离子方程式为______ 。
(3)阳离子交换膜为图中的______ 膜(填“a”或“b”)。
(4)此电池中,消耗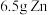 ,理论上可产生的容量(电量)为
,理论上可产生的容量(电量)为______ 毫安时(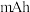 )(1 mol电子的电量为1 F,
)(1 mol电子的电量为1 F,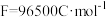 ,结果保留整数)
,结果保留整数)
(5)已知E为电池电动势(电池电动势即电池的理论电压,是两个电极电位之差,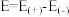 ),
), 为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较,
为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较,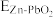
______ 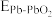 ;
;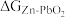
______  (填“>”或“<”)。
(填“>”或“<”)。
(6)Zn是一种重要的金属材料,工业上一般先将ZnS氧化,再采用热还原或者电解法制备。利用 还原ZnS也可得到Zn,其反应式如下:ZnS(s)+H2(g)
还原ZnS也可得到Zn,其反应式如下:ZnS(s)+H2(g) Zn(s)+H2S(g)。727℃时,上述反应的平衡常数
Zn(s)+H2S(g)。727℃时,上述反应的平衡常数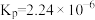 。此温度下,在盛有
。此温度下,在盛有 的刚性容器内通入压强为
的刚性容器内通入压强为 的
的 ,达平衡时
,达平衡时 的分压为
的分压为______ Pa(结果保留两位小数)。
 电池,电解质为
电池,电解质为 、
、 和
和 ,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
回答下列问题:
(1)电池中,
 为
为 ”、“
”、“ ”或“
”或“ ”)。
”)。(2)电池反应的离子方程式为
(3)阳离子交换膜为图中的
(4)此电池中,消耗
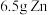 ,理论上可产生的容量(电量)为
,理论上可产生的容量(电量)为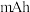 )(1 mol电子的电量为1 F,
)(1 mol电子的电量为1 F,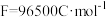 ,结果保留整数)
,结果保留整数)(5)已知E为电池电动势(电池电动势即电池的理论电压,是两个电极电位之差,
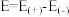 ),
), 为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较,
为电池反应的自由能变,则该电池与传统铅酸蓄电池相比较,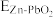
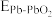 ;
;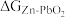
 (填“>”或“<”)。
(填“>”或“<”)。(6)Zn是一种重要的金属材料,工业上一般先将ZnS氧化,再采用热还原或者电解法制备。利用
 还原ZnS也可得到Zn,其反应式如下:ZnS(s)+H2(g)
还原ZnS也可得到Zn,其反应式如下:ZnS(s)+H2(g)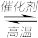 Zn(s)+H2S(g)。727℃时,上述反应的平衡常数
Zn(s)+H2S(g)。727℃时,上述反应的平衡常数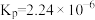 。此温度下,在盛有
。此温度下,在盛有 的刚性容器内通入压强为
的刚性容器内通入压强为 的
的 ,达平衡时
,达平衡时 的分压为
的分压为
您最近一年使用:0次
2021-01-25更新
|
858次组卷
|
3卷引用:难点6 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(新高考)
(已下线)难点6 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(新高考)河北省2021年普通高中学业水平选择考适应性测试化学试题广西钦州市第四中学2020-2021学年高一下学期4月月考化学试题1
名校
7 . 关于铜电极,下列说法正确的是
| A.在铜锌原电池中,铜作负极 | B.在电解精炼铜中,精铜作阴极 |
| C.在电解氧化铝制备金属铝中,铜做阳极 | D.向钥匙上镀铜时,钥匙作阳极 |
您最近一年使用:0次
8 . 我国科学家提出了一种利用锂化磷酸钒锂[Li5V2(PO4)3]实现“先予后取”的自预锂化原理,并应用锂化磷酸钒锂和硬碳组成了具有高比能量、高比功率和宽工作温区的全电池,示意图如图所示。在充电过程中,锂离子从Li5V2(PO4)3中脱出嵌入到硬碳(C)构成Li2C,充电反应为Li5V2(PO4)3+C =Li3V2(PO4)3+Li2C。下列说法错误的是


| A.充电时M与外接电源正极相连 |
| B.充电过程中Li+向硬碳电极移动 |
| C.该电池放电时,正极反应为Li3V2(PO4)3+2Li++2e-= Li5V2(PO4)3 |
| D.该电池放电时,负极质量增加 |
您最近一年使用:0次
名校
9 . 某研究机构使用Li—SO2Cl2电池作为电源电解制备Ni(H2PO2)2,其工作原理如图所示。已知电池反应为2Li+SO2Cl2=2LiCl+SO2↑,下列说法错误的是
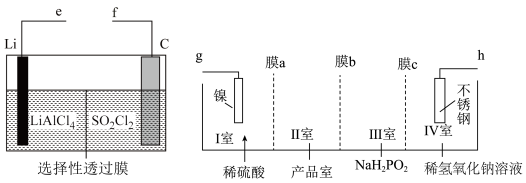

| A.电池中C电极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑ |
| B.电池的e极连接电解池的g极 |
| C.膜a、c是阳离子交换膜,膜b是阴离子交换膜 |
| D.电解池中不锈钢电极附近溶液的pH增大 |
您最近一年使用:0次
2021-01-01更新
|
2008次组卷
|
15卷引用:解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)课时31 新型电解池装置-2022年高考化学一轮复习小题多维练(全国通用)北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题四川省成都市树德中学2020-2021学年高二下学期4月月考化学试题(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)回归教材重难点07 重温“两池”原理-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)第4讲 电解池 金属的电化学腐蚀与防护河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三上学期第一次诊断考试化学试题山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题山东省2022-2023学年高二上学期学业水平测试化学试题福建省泉州市第七中学2022-2023学年高三上学期期中考化学试题山东省郓城第一中学2023-2024学年高二上学期开学考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期第一次月考化学试题
10 . 人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇,回答下列问题:
(1)已知下列热化学方程式:
①2CO2(g) + 6H2(g) = CH3OCH3(g) +3H2O(g) ΔH1=−122.6kJ·mol−1
②CH3OCH3(g) + H2O(g) = 2CH3OH(g) ΔH2=+23.4kJ·mol−1
则用CO2(g)与H2(g)反应合成CH3OH(g)的热化学方程式③_______________________
(2)一定条件下,向某密闭容器中按照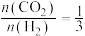 投料,发生反应③,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如图所示:
投料,发生反应③,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如图所示:

①由上图可知,反应物的转化率与压强的关系是:减小压强,CO2的转化率______ (填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________ MPa-2(Kp为用分压表示的平衡常数,分压=总压×体积分数)
②一定温度下,能说明上述反应已达化学平衡状态的是__________________ (填字母)
A.混合气体密度保持不变 B.混合气体的平均摩尔质量不变
C.反应容器内压强保持不变 D.单位时间内生成1 mol H2O,同时消耗3 mol H2
(3)将一定量的CO2(g)与H2(g)混合气体通入某密闭容器中,在催化剂作用下生成CH3OH(g),不同压强下,平衡时混合气体中CH3OH(g)的体积分数随温度的变化如图一所示。则A、C、D三点的平衡常数由大到小的顺序为_____________ (用KA、KC、KD表示),E点变为C点的措施是________________ 。

(4)我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为:4Na+3CO2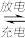 2Na2CO3+C,其工作原理如图二所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图二所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
①放电时,正极电极反应式为_________
②充电时,碳纳米管连接直流电源的____ 极,电解质溶液中Na+从____ 极区向____ 极区移动。
(1)已知下列热化学方程式:
①2CO2(g) + 6H2(g) = CH3OCH3(g) +3H2O(g) ΔH1=−122.6kJ·mol−1
②CH3OCH3(g) + H2O(g) = 2CH3OH(g) ΔH2=+23.4kJ·mol−1
则用CO2(g)与H2(g)反应合成CH3OH(g)的热化学方程式③
(2)一定条件下,向某密闭容器中按照
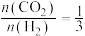 投料,发生反应③,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如图所示:
投料,发生反应③,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如图所示:
①由上图可知,反应物的转化率与压强的关系是:减小压强,CO2的转化率
②一定温度下,能说明上述反应已达化学平衡状态的是
A.混合气体密度保持不变 B.混合气体的平均摩尔质量不变
C.反应容器内压强保持不变 D.单位时间内生成1 mol H2O,同时消耗3 mol H2
(3)将一定量的CO2(g)与H2(g)混合气体通入某密闭容器中,在催化剂作用下生成CH3OH(g),不同压强下,平衡时混合气体中CH3OH(g)的体积分数随温度的变化如图一所示。则A、C、D三点的平衡常数由大到小的顺序为

(4)我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为:4Na+3CO2
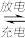 2Na2CO3+C,其工作原理如图二所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图二所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。①放电时,正极电极反应式为
②充电时,碳纳米管连接直流电源的
您最近一年使用:0次



