福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建
高二
期末
2021-02-13
379次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、认识化学科学、常见无机物及其应用、化学实验基础
福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建
高二
期末
2021-02-13
379次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 下列说法错误的是
| A.太阳能电池可将光能转化为电能 |
| B.利用植物秸秆制取酒精是有效利用其中的生物质能的方法之一 |
| C.使用电解水法制取氢气可以有效利用能源 |
| D.太阳能、风能资源丰富,在使用时对环境无污染或污染很少,是绿色能源 |
【知识点】 能源开发利用新理念
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列有关化学能与热能的说法正确的是
| A.吸热反应在常温或低温条件下都难以发生 |
| B.已知C(金刚石,s)=C(石墨,s) △H=-1.9 kJ·mol-1,则金刚石比石墨稳定 |
| C.H2→H+H的变化需要吸收能量 |
| D.反应C(s)+CO2(g)=2CO(g)为放热反应 |
您最近一年使用:0次
3. 下列有关电化学原理及其应用的相关说法正确的是
| A.燃料电池放电时,化学能全部转化为电能 |
| B.电热水器在不锈钢内胆上镶铜棒可以防止内胆腐蚀 |
| C.电解法精炼铜的过程中,电解质溶液的质量保持不变 |
| D.电解可以使反应Cu+Zn2+=Zn+Cu2+发生 |
您最近一年使用:0次
单选题
|
较易(0.85)
4. 下列物质中属于电解质,但在给定条件下不能导电的是
| A.H2SO4 | B.CCl4 | C.石墨 | D.KOH溶液 |
【知识点】 非电解质、电解质物质类别判断解读 物质水溶液的导电性解读
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
5. 下列说法中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热△H<-57.3 kJ·mol-1 |
| B.H2(g)的燃烧热是285.8 kJ·mol-1,则反应2H2O(l)=2H2(g)+O2(g)的△H=+571.6 kJ·mol-1 |
| C.H原子的能量一定高于H2的能量 |
| D.放热反应中正反应的活化能高于逆反应的活化能 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 25℃时,下列各组离子在指定条件下,一定能大量共存的是
A.能使石蕊溶液变红的溶液中:Fe3+、Na+、 、I- 、I- |
B.由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Ba2+、K+、 、Cl- 、Cl- |
C.无色透明的溶液中:K+、 、 、 、 、 |
D.中性溶液中:Al3+、Mg2+、Cl-、 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 某兴趣小组在实验室通过镁粉和空气中的氮气制备氮化镁(可与水发生反应),其装置如下图所示。已知:维生素C具有较强的还原性。下列说法错误的是

| A.装置①③中盛放的分别是NaOH溶液和浓硫酸 | B.装置②的作用为吸收空气中的O2 |
| C.实验开始时应先通空气再点燃酒精灯 | D.装置⑤中碱石灰可以替换为NaCl |
您最近一年使用:0次
2021-02-11更新
|
807次组卷
|
7卷引用:福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题(已下线)课时15 镁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题07 铝、镁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第08讲 金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江西省吉安市遂川中学2022-2023学年高一上学期期末考试化学试题山东省聊城市临清市第一中学2023-2024学年高一上学期期末模拟考试化学试题
单选题
|
适中(0.65)
8. 如图所示是我国科学家研制的一种新型燃料电池,成功实现了有机废弃物的处理和能源的利用。下列说法正确的是


| A.该电池作精炼铜的电解池的电源时,a极应该连接粗铜 |
B.负极区发生反应HCOO-+2OH--2e-= +H2O +H2O |
| C.物质A是硫酸亚铁 |
| D.每处理1 mol HCOO-,理论上生成0.5 mol K2SO4 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
9. 氧化亚铜是一种重要的工业原料,氧化亚铜与氧气反应的能量变化如图所示。已知:1gC(s)燃烧全部生成CO(g)放出9.2 kJ热量。

下列说法错误的是

下列说法错误的是
| A.C(s)的燃烧热△H<-110.4 kJ·mol-1 |
| B.氧化亚铜与氧气的反应为放热反应 |
| C.氧化亚铜与氧气反应的活化能为292 kJ·mol-1 |
| D.足量炭粉与CuO反应生成Cu2O的热化学方程式为C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+35.6 kJ·mol-1 |
您最近一年使用:0次
2021-02-11更新
|
233次组卷
|
2卷引用:福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
单选题
|
适中(0.65)
名校
10. 以CH4、O2、熔融Na2CO3组成的燃料电池电解制备N2O5,装置如图所示,右侧池中隔膜仅允许H+通过。下列说法错误的是


A.石墨1上的电极反应式为CH4+4 -8e-=5CO2+2H2O -8e-=5CO2+2H2O |
| B.右侧池中H+由Pt1极通过隔膜移向Pt2极 |
| C.Pt1极上的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+ |
| D.每制得1 mol N2O5,理论上消耗O2 11.2 L(标准状况下) |
【知识点】 烃燃料电池解读 原电池、电解池综合考查解读
您最近一年使用:0次
2021-02-11更新
|
470次组卷
|
3卷引用:福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题(已下线)专题09 电化学基础-备战2021届高考化学二轮复习题型专练 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
单选题
|
适中(0.65)
11. 下列实验操作、现象以及得出的结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向滴有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅并且有白色沉淀生成 | Na2CO3溶液中存在水解平衡 |
| B | 向AgCl固体上滴加5滴饱和KI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 取相同体积和相同浓度的两份H2C2O4溶液,同时滴加0.1mol‧L-1的KMnO4溶液和1.0mol‧L-1的KMnO4溶液2mL | 0.1mol‧L-1的KMnO4的溶液先褪色 | 探究浓度对化学反应速率的影响 |
| D | 向淀粉溶液中加入稀硫酸并微热一段时间,再向所得溶液中加入新制氢氧化铜悬浊液,加热 | 没有红色沉淀产生 | 淀粉没有水解 |
| A.A | B.B | C.C | D.D |
【知识点】 沉淀转化解读 化学实验方案的设计与评价
您最近一年使用:0次
单选题
|
适中(0.65)
12. 常温下,在20.00 mL 0.1000 mol·L-1氨水中逐滴滴加0.1000 mol·L-1盐酸,溶液pH随滴入盐酸体积的变化曲线如图所示。下列说法正确的是


A.①溶液中:c(NH3·H2O)+c(OH-)=c( )+c(H+) )+c(H+) |
B.②溶液中:c( )=c(Cl-)=0.0500 mol·L-1 )=c(Cl-)=0.0500 mol·L-1 |
| C.①②③3点所示的溶液中水的电离程度:③>②>① |
D.③溶液中:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
13. 从海水中提取粗盐后,所得母液可用于提取镁,流程如下:
海水 母液
母液 Mg(OH)2
Mg(OH)2 MgCl2溶液
MgCl2溶液 MgCl2·6H2O
MgCl2·6H2O MgCl2
MgCl2 Mg
Mg
下列说法错误的是
海水
 母液
母液 Mg(OH)2
Mg(OH)2 MgCl2溶液
MgCl2溶液 MgCl2·6H2O
MgCl2·6H2O MgCl2
MgCl2 Mg
Mg下列说法错误的是
| A.经过步骤①②③,MgCl2得到富集 |
| B.步骤①④均用到结晶操作,步骤①②④均用到过滤操作 |
| C.在水溶液中,MgCl2会部分水解,是因为MgCl2是弱电解质 |
| D.步骤⑥得到的另一产物可间接用于该提取镁的流程 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
14. 常温下,向1 L 0.01 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下,Kb(NH3·H2O)=1.75×10-5,忽略温度和溶液体积的改变],混合溶液的lg 与pH的变化关系如图所示。下列叙述正确的是
与pH的变化关系如图所示。下列叙述正确的是

 与pH的变化关系如图所示。下列叙述正确的是
与pH的变化关系如图所示。下列叙述正确的是
| A.该温度下,Ka(HR)=10-5 |
B.随着氨气的通入, 逐渐减小 逐渐减小 |
| C.0.01 mol·L-1 HR溶液的pH约为6 |
D.当通入0.01 mol NH3时,溶液中存在:c( )>c(R-)>c(OH-)>c(H+) )>c(R-)>c(OH-)>c(H+) |
【知识点】 电离平衡常数及影响因素解读 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
15. 用起始质量相同的两根铁棒作电极电解500 mL 0.2 mol·L-1的AgNO3溶液,当两极质量相差16.4 g时,阴极收集到的气体在标准状况下的体积为
| A.1120 mL | B.2240 mL | C.3360 mL | D.4480 mL |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
16. 硫化汞常用于彩色封蜡、塑料、橡胶和医药及防腐剂等方面。不同温度下HgS在水中的沉淀溶解平衡曲线如图所示。已知:HgS溶解的过程中吸收热量。下列说法正确的是
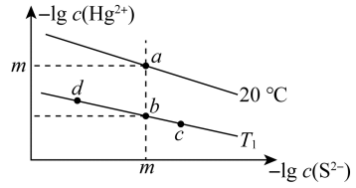

| A.图中T1<20℃ |
| B.升高温度可实现b点向a点的转化 |
| C.向b点对应的溶液中加入少量Na2S固体,b点向c点方向移动 |
| D.20℃时,HgS的饱和溶液的物质的量浓度为10-m mol·L-1 |
您最近一年使用:0次
2021-02-11更新
|
355次组卷
|
4卷引用:福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题
福建省福州市八县(市)一中2020-2021学年高二上学期期末联考化学试题(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)四川省凉山州会理市民族实验中学2021-2022学年高三上学期第一次月考化学试题 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
17. 已知:25℃时,Ka(CH3COOH)=1.75×10-5,Ka(HClO)=2.95×10-8,Ka1(H2CO3)=4.30×10-7、Ka2(H2CO3)=5.61×10-11,Ka1(H2SO3)=1.54×10-2、Ka2(H2SO3)=1.02×10-7。回答下列问题:
(1)写出碳酸的第一步电离平衡常数表达式Ka1(H2CO3)=___________ 。
(2)在相同条件下,等pH的CH3COONa、NaClO、Na2CO3和Na2SO34种溶液中溶质浓度由大到小的顺序为___________ 。等物质的量浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度由大到小的顺序为___________ 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列的量会变小的是___________ (填字母)。
a.c(CH3COO-) b.c(H+) c.
(4)下列离子方程式中书写错误的是___________ (填字母)。
a.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-= +2HClO
+2HClO
b.少量SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
c.少量Cl2通入Na2CO3溶液中:Cl2+2 +H2O=Cl-+2
+H2O=Cl-+2 +ClO-
+ClO-
(1)写出碳酸的第一步电离平衡常数表达式Ka1(H2CO3)=
(2)在相同条件下,等pH的CH3COONa、NaClO、Na2CO3和Na2SO34种溶液中溶质浓度由大到小的顺序为
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列的量会变小的是
a.c(CH3COO-) b.c(H+) c.

(4)下列离子方程式中书写错误的是
a.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=
 +2HClO
+2HClOb.少量SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
c.少量Cl2通入Na2CO3溶液中:Cl2+2
 +H2O=Cl-+2
+H2O=Cl-+2 +ClO-
+ClO-
您最近一年使用:0次
三、解答题 添加题型下试题
18. 硫化氢(H2S)危害人体健康,造成环境污染。工业上可采用如下反应处理含H2S的尾气。请回答下列问题:
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=_____ ,1 mol S(s)完全燃烧放出的热量______ (填“>”“<”或“=”)314.27 kJ。
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是___________ (填字母)。
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=___________ mol·L-1·min-1,H2S的转化率为___________ %,化学平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度表示,平衡分压=总压×物质的量分数)。
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将___________ (填“增大”“减小”或“不变”)。
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为___________ 。
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为____ (列出计算式即可)。
(1)已知:
I.S(g)+O2(g)=SO2(g) △H1=-314.27 kJ·mol-1;
II.2H2S(g)+O2(g)=2S(g)+2H2O(g) △H2=-407.07 kJ·mol-1
则2H2S(g)+SO2(g)=3S(g)+2H2O(g) △H=
(2)H2S直接分解可制取H2:2H2S(g)⇌2H2(g)+S2(g) △H>0.一定温度下,起始压强为100 MPa,在体积为5 L的恒容密闭容器中充入1 mol H2S气体,发生该反应。
①下列说法可以判定该反应达到平衡状态的是
A.H2S与H2的物质的量之比不再改变 B.气体的密度不再改变
C.断裂2 mol H-S键的同时断裂1 mol H-H键 D.气体的平均摩尔质量不再改变
②若10 min时反应达到平衡,压强变为原来的1.25倍,则从开始到平衡,v(H2)=
③若保持其他条件不变,将反应容器改为绝热恒容的密闭容器,则重新达到平衡时,S2(g)的体积分数与原平衡相比将
(3)H2S燃料电池的开发成功,使得H2S可以作为一种新型能源被资源化利用,基本工作原理如图所示。

①该电池工作时,负极的电极反应式为
②已知1个电子的电量是1.602×10-19 C.则1 kg H2S输出的电量为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
19. 铵明矾[NH4Al(SO4)2·12H2O]常用作沉淀剂、絮凝剂、泡沫灭火器的内留剂。某化学小组拟用工业废氧化铝粉末(主要成分是Al2O3,还有少量的Fe2O3和MgO等杂质)制备铵明矾,制备流程如图所示。回答下列问题:

(1)0.1 mol·L-1铵明矾溶液中各离子浓度从大到小的顺序为___________ 。
(2)写出由滤液A生成Al(OH)3沉淀的离子方程式:___________ 。
(3)加稀硫酸溶解Al(OH)3沉淀要使溶液的pH小于2,目的是______ 。该反应为_____ (填“吸热反应”或“放热反应”)。
(4)样品中NH4Al(SO4)2·12H2O的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去)。

精确称取w g样品于蒸馏烧瓶中,加150 mL水溶解,然后逐滴加入足量10% NaOH溶液,加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液,确保样品溶液中的氨全部蒸出,用V1 mL c1 mol·L-1的硫酸吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过量的硫酸,到达终点时消耗V2 mL NaOH溶液。
①用NaOH标准溶液滴定过量的硫酸时,应使用______ 式滴定管(填“酸”或“碱”),可使用的指示剂为_________ 。
②样品中 的质量分数表达式为
的质量分数表达式为_______ 。

(1)0.1 mol·L-1铵明矾溶液中各离子浓度从大到小的顺序为
(2)写出由滤液A生成Al(OH)3沉淀的离子方程式:
(3)加稀硫酸溶解Al(OH)3沉淀要使溶液的pH小于2,目的是
(4)样品中NH4Al(SO4)2·12H2O的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去)。

精确称取w g样品于蒸馏烧瓶中,加150 mL水溶解,然后逐滴加入足量10% NaOH溶液,加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液,确保样品溶液中的氨全部蒸出,用V1 mL c1 mol·L-1的硫酸吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过量的硫酸,到达终点时消耗V2 mL NaOH溶液。
①用NaOH标准溶液滴定过量的硫酸时,应使用
②样品中
 的质量分数表达式为
的质量分数表达式为【知识点】 离子反应的发生及书写 酸碱中和滴定 盐类水解的应用 物质含量的测定
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
20. 根据我国“煤多、油少”的能源构成格局,中国科学院大连物化所自主研发出了以煤炭为基本原料先制备出甲醇,在催化剂存在条件下,再利用甲醇制备出乙烯和丙烯的新型“煤代油”技术(简称MTO技术)。该技术涉及的主要反应为:
反应I:2CH3OH(g)⇌CH2=CH2(g)+2H2O(g) △H1=-11.72 kJ·mol-1;
反应II:3CH3OH(g)⇌CH2=CH-CH3(g)+3H2O(g) △H2=-30.98 kJ·mol-1。
请回答下列问题:
(1)反应I能自发进行的条件为___________ (填“高温自发”“低温自发”或“高低温均能自发”)。
(2)具有笼状结构的SAPO-34分子筛是MTO技术中常用的催化剂,其在CH3OH(g)烯烃化的过程中的示意图如图甲所示。
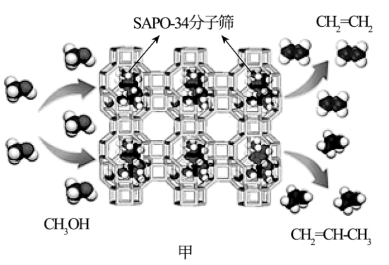
①T K时,在SAPO-34分子筛作用下,在体积为1 L的恒容密闭容器中充入1 mol CH3OH(g)发生反应I和反应II,测得起始时容器内的压强为p0,平衡后容器内的压强为1.3 p0,H2O(g)的物质的量浓度为0.7 mol·L-1,则平衡后CH2=CH-CH3(g)的体积分数为_____ ,T K时反应II的平衡常数K=______ (结果均保留3位有效数字)。
②在SAPO-34分子筛作用下,反应过程中一定要防止积碳的产生,若产生积碳,造成的后果为_________ (答1点即可)。
(3)环氧乙烷( )是重要的化工原料,工业上常用甲酰胺(
)是重要的化工原料,工业上常用甲酰胺( )-H2O2氧化乙烯来制备环氧乙烷,我国学者结合实验和计算机模拟结果,研究了该反应在常温下,水分子作催化剂时的反应过程,如图乙所示。
)-H2O2氧化乙烯来制备环氧乙烷,我国学者结合实验和计算机模拟结果,研究了该反应在常温下,水分子作催化剂时的反应过程,如图乙所示。

甲酰胺H2O2氧化乙烯来制备环氧乙烷的△H________ 0(填“>”“<”或“=”)。该过程中最大能垒(活化能)E正=_______ kJ·mol-1,写出该步骤的化学方程式:________ 。
反应I:2CH3OH(g)⇌CH2=CH2(g)+2H2O(g) △H1=-11.72 kJ·mol-1;
反应II:3CH3OH(g)⇌CH2=CH-CH3(g)+3H2O(g) △H2=-30.98 kJ·mol-1。
请回答下列问题:
(1)反应I能自发进行的条件为
(2)具有笼状结构的SAPO-34分子筛是MTO技术中常用的催化剂,其在CH3OH(g)烯烃化的过程中的示意图如图甲所示。

①T K时,在SAPO-34分子筛作用下,在体积为1 L的恒容密闭容器中充入1 mol CH3OH(g)发生反应I和反应II,测得起始时容器内的压强为p0,平衡后容器内的压强为1.3 p0,H2O(g)的物质的量浓度为0.7 mol·L-1,则平衡后CH2=CH-CH3(g)的体积分数为
②在SAPO-34分子筛作用下,反应过程中一定要防止积碳的产生,若产生积碳,造成的后果为
(3)环氧乙烷(
 )是重要的化工原料,工业上常用甲酰胺(
)是重要的化工原料,工业上常用甲酰胺( )-H2O2氧化乙烯来制备环氧乙烷,我国学者结合实验和计算机模拟结果,研究了该反应在常温下,水分子作催化剂时的反应过程,如图乙所示。
)-H2O2氧化乙烯来制备环氧乙烷,我国学者结合实验和计算机模拟结果,研究了该反应在常温下,水分子作催化剂时的反应过程,如图乙所示。
甲酰胺H2O2氧化乙烯来制备环氧乙烷的△H
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、化学反应原理、认识化学科学、常见无机物及其应用、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
16
填空题
1
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 能源开发利用新理念 | |
| 2 | 0.65 | 化学反应中能量变化的原因 化学能与物质稳定性之间的关系 热化学方程式含义 | |
| 3 | 0.85 | 电解原理的应用 铜的电解精炼 金属的防护 | |
| 4 | 0.85 | 非电解质、电解质物质类别判断 物质水溶液的导电性 | |
| 5 | 0.85 | 中和热 燃烧热概念 | |
| 6 | 0.65 | 限定条件下的离子共存 影响水电离的因素 盐类水解的原理 盐类双水解反应 | |
| 7 | 0.65 | 含镁化合物 镁原子的结构与化学性质 物质制备的探究 | |
| 8 | 0.65 | 原电池原理 铜的电解精炼 | |
| 9 | 0.65 | 化学反应热的计算 热化学方程式书写及正误判断 盖斯定律与热化学方程式 | |
| 10 | 0.65 | 烃燃料电池 原电池、电解池综合考查 | |
| 11 | 0.65 | 沉淀转化 化学实验方案的设计与评价 | |
| 12 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 13 | 0.65 | 盐类水解规律 海水提取镁 | |
| 14 | 0.65 | 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 | |
| 15 | 0.65 | 电解池有关计算 | |
| 16 | 0.65 | 浓度对难溶电解质溶解平衡的影响 温度对难溶电解质溶解平衡的影响 | |
| 二、填空题 | |||
| 17 | 0.65 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 | |
| 三、解答题 | |||
| 18 | 0.65 | 盖斯定律及其有关计算 化学平衡常数的有关计算 转化率的相关计算及判断 燃料电池 | 原理综合题 |
| 19 | 0.65 | 离子反应的发生及书写 酸碱中和滴定 盐类水解的应用 物质含量的测定 | 原理综合题 |
| 20 | 0.65 | 盖斯定律与热化学方程式 化学平衡常数的有关计算 化学反应进行方向的判据 | 原理综合题 |



