1 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
(1)Cu2O为砖红色固体,不溶于水;
(2)Cu2SO3为黄色固体,不溶于水;
(3)[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol•L-1的CuSO4溶液中滴加0.2mol•L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃2mL0.2mol•L-1的CuSO4溶液中滴加0.2mol•L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol•L-1的Na2SO3溶液中滴加0.2mol•L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(2)若要进一步检验黄色沉淀中有Cu(OH)2,可采用的具体实验方法为_______ 。
(3)经检验,实验2所得溶液中有大量SO 、HSO
、HSO 生成。该实验中Cu2+表现氧化性,写出该实验中反应的离子方程式:
生成。该实验中Cu2+表现氧化性,写出该实验中反应的离子方程式:_______ 。
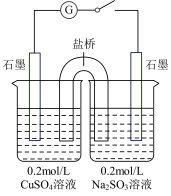
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
(1)Cu2O为砖红色固体,不溶于水;
(2)Cu2SO3为黄色固体,不溶于水;
(3)[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol•L-1的CuSO4溶液中滴加0.2mol•L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃2mL0.2mol•L-1的CuSO4溶液中滴加0.2mol•L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol•L-1的Na2SO3溶液中滴加0.2mol•L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(2)若要进一步检验黄色沉淀中有Cu(OH)2,可采用的具体实验方法为
(3)经检验,实验2所得溶液中有大量SO
 、HSO
、HSO 生成。该实验中Cu2+表现氧化性,写出该实验中反应的离子方程式:
生成。该实验中Cu2+表现氧化性,写出该实验中反应的离子方程式:(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
解题方法
2 . 以石墨作电极,电解AgNO3溶液,可在两极分别得到Ag和O2,下列说法正确的是
A.氧化性:Ag+ > H+,还原性:NO > OH- > OH- |
| B.Ag附着在阳极:Ag+ + e-=Ag |
| C.电解过程中溶液的酸性将逐渐减弱 |
| D.电路中每转移1mol电子,可生成1molAg和0.25molO2 |
您最近一年使用:0次
2020-11-09更新
|
1018次组卷
|
7卷引用:【教材实验热点】09 化学能与电能
(已下线)【教材实验热点】09 化学能与电能北京市丰台区2020-2021学年高二上学期期中考试化学试题(已下线)专题4.3.1 电解原理-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第四章 电化学基础(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)4.3.1 电解原理(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)4.2.1 电解原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第四章 化学反应与电能(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
3 .  是重要的化工原料,由软锰矿制备
是重要的化工原料,由软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:

资料:①软锰矿的主要成分为 ,主要杂质有
,主要杂质有 和
和
②金属离子沉淀的pH
③该工艺条件下, 与
与 反应。
反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是_______ 。
②溶出时,Fe的氧化过程及得到 的主要途径如图所示:
的主要途径如图所示:

a.步骤Ⅱ是从软锰矿中溶出 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是_______ 。
b.若 全部来自于反应
全部来自于反应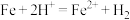 ,完全溶出
,完全溶出 所需Fe与
所需Fe与 的物质的量比值为2。而实际比值小于2,原因是
的物质的量比值为2。而实际比值小于2,原因是_______ 。
(2)纯化的目的是为了除去溶液中的杂质。已知:溶液pH越小, 的氧化性越强。纯化时先加入
的氧化性越强。纯化时先加入_______ ,后加入_______ (选填“氨水”、“ ”)调溶液pH
”)调溶液pH_______ ~_______ ,调pH到此范围的目的是_______ 。
(3)电解。 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是_______ 。
(4)产品纯度测定。向0.45g产品中加入1.34g 和足量稀硫酸,加热至充分反应。再用0.1000mol·L
和足量稀硫酸,加热至充分反应。再用0.1000mol·L
 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为20.00mL。
溶液的体积为20.00mL。
已知: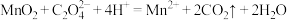 ,
,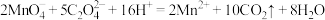 ,计算该产品的纯度。(写出计算过程)
,计算该产品的纯度。(写出计算过程)_______ 。
 是重要的化工原料,由软锰矿制备
是重要的化工原料,由软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:
资料:①软锰矿的主要成分为
 ,主要杂质有
,主要杂质有 和
和
②金属离子沉淀的pH
 |  |  |  | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
 与
与 反应。
反应。(1)溶出
①溶出前,软锰矿需研磨。目的是
②溶出时,Fe的氧化过程及得到
 的主要途径如图所示:
的主要途径如图所示:
a.步骤Ⅱ是从软锰矿中溶出
 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是b.若
 全部来自于反应
全部来自于反应 ,完全溶出
,完全溶出 所需Fe与
所需Fe与 的物质的量比值为2。而实际比值小于2,原因是
的物质的量比值为2。而实际比值小于2,原因是(2)纯化的目的是为了除去溶液中的杂质。已知:溶液pH越小,
 的氧化性越强。纯化时先加入
的氧化性越强。纯化时先加入 ”)调溶液pH
”)调溶液pH(3)电解。
 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是(4)产品纯度测定。向0.45g产品中加入1.34g
 和足量稀硫酸,加热至充分反应。再用0.1000mol·L
和足量稀硫酸,加热至充分反应。再用0.1000mol·L
 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为20.00mL。
溶液的体积为20.00mL。已知:
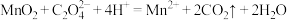 ,
,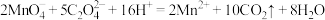 ,计算该产品的纯度。(写出计算过程)
,计算该产品的纯度。(写出计算过程)
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 .  是重要的化工原料,由软锰矿制备
是重要的化工原料,由软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:

资料:①软锰矿的主要成分为 ,主要杂质有
,主要杂质有 和
和 。
。
②金属离子开始沉淀和完全沉淀时的 :
:
③该工艺条件下, 与
与 ,不反应。
,不反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是_______ 。
②溶出时, 的氧化过程及得到
的氧化过程及得到 主要途径如图所示。
主要途径如图所示。
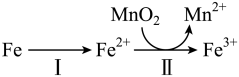
ⅰ.步骤Ⅰ是从软锰矿中溶出 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是_______ 。
ⅱ.若 全部来自于反
全部来自于反 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2.而实际比值(0.9)小于2,原因是
的物质的量比值为2.而实际比值(0.9)小于2,原因是_______ 。
(2)纯化
已知: 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,后加入
,后加入 ,调溶液
,调溶液 ,说明试剂加入顺序及调节
,说明试剂加入顺序及调节 的原因:
的原因:_______ 。
(3)电解
 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是_______ 。
(4)产品纯度测定
向ag产品中依次加入足量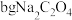 和足量稀
和足量稀 ,加热至充分反应,再用
,加热至充分反应,再用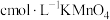 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为dL(已知:
溶液的体积为dL(已知: 及
及 均被还原为
均被还原为 。相对分子质量:
。相对分子质量: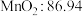 、
、 :)。
:)。
产品纯度为_______ (用质量分数表示)。
 是重要的化工原料,由软锰矿制备
是重要的化工原料,由软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:
资料:①软锰矿的主要成分为
 ,主要杂质有
,主要杂质有 和
和 。
。②金属离子开始沉淀和完全沉淀时的
 :
: |  |  |  | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
 与
与 ,不反应。
,不反应。(1)溶出
①溶出前,软锰矿需研磨。目的是
②溶出时,
 的氧化过程及得到
的氧化过程及得到 主要途径如图所示。
主要途径如图所示。
ⅰ.步骤Ⅰ是从软锰矿中溶出
 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是ⅱ.若
 全部来自于反
全部来自于反 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2.而实际比值(0.9)小于2,原因是
的物质的量比值为2.而实际比值(0.9)小于2,原因是(2)纯化
已知:
 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,后加入
,后加入 ,调溶液
,调溶液 ,说明试剂加入顺序及调节
,说明试剂加入顺序及调节 的原因:
的原因:(3)电解
 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是(4)产品纯度测定
向ag产品中依次加入足量
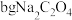 和足量稀
和足量稀 ,加热至充分反应,再用
,加热至充分反应,再用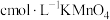 溶液滴定剩余
溶液滴定剩余 至终点,消耗
至终点,消耗 溶液的体积为dL(已知:
溶液的体积为dL(已知: 及
及 均被还原为
均被还原为 。相对分子质量:
。相对分子质量: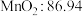 、
、 :)。
:)。产品纯度为
您最近一年使用:0次
5 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。
【查阅资料】①Cu2++2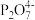
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109
②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是_______ (填仪器名称)。
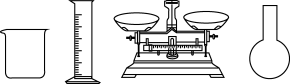
(2)镀件表面的油污可用_______ 清洗。
(3)电镀时阴极上发生的主要反应的电极反应式为_______ 。
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率v(Cu)=_______ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是_______ 。
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是_______ 。
(7)本实验电镀的最佳条件是pH为8.5、_______ 、_______ 。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为_______ ,通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①Cu2++2
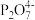
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
| 实验信号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是
(7)本实验电镀的最佳条件是pH为8.5、
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
6 . 自然界中锰是含量较高的元素,分布在海洋深处与地壳中,它有多种化合价,如KMnO4(Ⅶ)、K2MnO4(Ⅵ)、MnO2(Ⅳ)等具有氧化性,MnSO4(Ⅱ)等具有还原性。工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式___________ 。
您最近一年使用:0次
名校
解题方法
7 . 常用电解法处理工业废水中的乙醛。该过程中发生的电极反应为:
①4H2O+4e-=2H2↑+4OH-
②CH3CHO+3H2O-10e-=2CO2↑+10H+
③2H2O-4e-=O2↑+4H+
④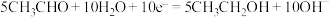
⑤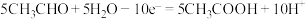
下列说法错误的是
①4H2O+4e-=2H2↑+4OH-
②CH3CHO+3H2O-10e-=2CO2↑+10H+
③2H2O-4e-=O2↑+4H+
④
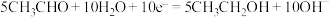
⑤
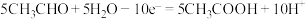
下列说法错误的是
| A.反应①⑤发生在阴极 |
| B.乙醛既体现氧化性又体现还原性 |
| C.当生成46g乙醇时,电路中转移2mol 电子 |
| D.电解过程中,电极附近溶液的pH: 阴极>阳极 |
您最近一年使用:0次
2021-03-18更新
|
620次组卷
|
4卷引用:小题17 新型电解池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题17 新型电解池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)专题08 电化学及其应用-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省青岛市2021届高三3月统一质量检测化学试题山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题
8 . 羟基自由基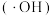 是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为CO2和H2O的原电池-电解池组合装置,实现了发电、环保两位一体。下列说法错误的是
是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为CO2和H2O的原电池-电解池组合装置,实现了发电、环保两位一体。下列说法错误的是
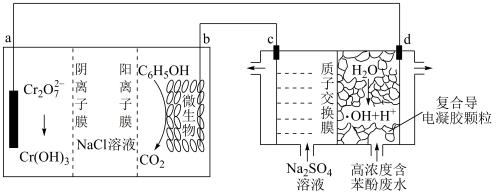
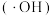 是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为CO2和H2O的原电池-电解池组合装置,实现了发电、环保两位一体。下列说法错误的是
是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为CO2和H2O的原电池-电解池组合装置,实现了发电、环保两位一体。下列说法错误的是
A.a极1 mol Cr2O 参与反应,理论上NaCl溶液中减少的离子为12NA 参与反应,理论上NaCl溶液中减少的离子为12NA |
| B.电池工作时,b极附近pH减小 |
| C.右侧装置中,c、d两极产生气体的体积比(相同条件下)为7:3 |
D.d极区苯酚被氧化的化学方程式为 |
您最近一年使用:0次
2023-08-31更新
|
822次组卷
|
7卷引用:考点3 电解池 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
(已下线)考点3 电解池 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖南师范大学附属中学2022-2023学年高三上学期月考卷(六)化学试题湖南省株洲市第一中学2022-2023学年高三第六次月考化学试题福建省宁德市五校教学联合体2023届高三一模考试化学试题山东省济南市历城第二中学2023届高三上学期一轮复习验收考试化学试题福建省龙岩市上杭县第一中学2024届高三上学期10月月考化学试题云南省曲靖市第一中学2023-2024学年高三上学期12月月考理综试题
9 . 双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是__ 。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__ 。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为__ ,写出该反应的离子方程式__ 。
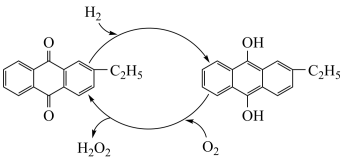
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式___ 。
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是__ 。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__ mol。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式

(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
您最近一年使用:0次
10 . 某小组实验探究不同条件下 溶液与
溶液与 溶液的反应。
溶液的反应。
已知:
i. 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色)。
(棕黑色)。
ii. 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
(1)实验I~III的操作过程中,加⼊ 溶液和物质a时,应先加
溶液和物质a时,应先加___________ 。
(2)实验I中, 的还原产物为
的还原产物为___________ 。
(3)实验II中发生反应的离子方程式为___________ 。
(4)已知:可从电极反应⻆度分析物质氧化性和还原性的变化。用电极反应式表示实验III中溶液变绿时发⽣的氧化反应___________ 。
(5)解释实验III中“⼀段时间后绿色消失,产生棕黑色沉淀”的原因___________ 。
(6)若想观察 溶液与
溶液与 溶液反应后溶液为持续稳定的绿色,设计实验方案
溶液反应后溶液为持续稳定的绿色,设计实验方案___________ 。
(7)改用0.1
 溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式___________ 。
 溶液与
溶液与 溶液的反应。
溶液的反应。已知:
i.
 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色)。
(棕黑色)。ii.
 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。| 实验 | 序号 | 物质a | 实验现象 |
| 4滴物质a 6滴(约0.3mL)0.1   溶液 溶液
  溶液 溶液 | I | 3  溶液 溶液 | 紫色溶液变浅至几乎无色 |
| II |  | 紫色褪去,产生棕黑色沉淀 | |
| III | 6 NaOH溶液 NaOH溶液 | 溶液变绿,⼀段时间后绿色消失,产生棕黑色沉淀 |
 溶液和物质a时,应先加
溶液和物质a时,应先加(2)实验I中,
 的还原产物为
的还原产物为(3)实验II中发生反应的离子方程式为
(4)已知:可从电极反应⻆度分析物质氧化性和还原性的变化。用电极反应式表示实验III中溶液变绿时发⽣的氧化反应
(5)解释实验III中“⼀段时间后绿色消失,产生棕黑色沉淀”的原因
(6)若想观察
 溶液与
溶液与 溶液反应后溶液为持续稳定的绿色,设计实验方案
溶液反应后溶液为持续稳定的绿色,设计实验方案(7)改用0.1

 溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
溶液重复实验I,发现紫色溶液变浅并产生棕黑沉淀,写出产生棕黑色沉淀的离子方程式
您最近一年使用:0次
2023-03-24更新
|
497次组卷
|
3卷引用:专题21 实验探究题