 ,常温常压下二氧化氯
,常温常压下二氧化氯 是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备
是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备 :
: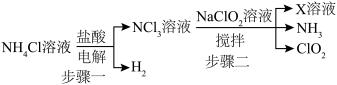
②
 在水溶液中很快水解成
在水溶液中很快水解成 和另一种化合物,该化合物名称为:
和另一种化合物,该化合物名称为: 酸性溶液条件下加入
酸性溶液条件下加入 反应的离子方程式为:
反应的离子方程式为:(2)纯
 易分解爆炸,故常与
易分解爆炸,故常与 的烧碱溶液反应生成
的烧碱溶液反应生成 保存,需要时再通过溶于酸溶液反应获得
保存,需要时再通过溶于酸溶液反应获得 ,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。
,该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是______。| A.亚氯酸钠有强氧化性,在溶液中水解显酸性 |
B. 和 和 在碱性溶液中反应时, 在碱性溶液中反应时, 表现还原性 表现还原性 |
C.将 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 溶液进行加热浓缩,蒸发结晶,过滤洗涤,得到 |
D.两份相同 溶液分别与等 溶液分别与等 的盐酸和硫酸反应,与盐酸反应可能快 的盐酸和硫酸反应,与盐酸反应可能快 |
(3)设计实验验证溶液
 中的金属阳离子与氯离子
中的金属阳离子与氯离子实验(一)制备并提纯硫化钠。
该化学兴趣小组在实验室模拟工业用煤粉还原法制备硫化钠,将芒硝(Na2SO4·10H2O)与过量的煤粉混合于800 ~ 1100°C高温下煅烧还原,生成物经冷却后用稀碱液热溶解、过滤,将滤液进行浓缩,再进行抽滤、洗涤、干燥,制得硫化钠产品。
(1)写出“高温还原”过程中的主要化学方程式:
(2)抽滤又称减压过滤,相比普通过滤,抽滤的主要优点是
实验(二)探究硫化钠的性质。
(3)为了探究Na2S的还原性,该小组按如图装置进行实验。

接通K,发现电流表指针发生偏转,左侧烧杯中溶液颜色逐渐变浅。实验完毕后,该小组查阅资料后猜测,S2-被氧化为
 。设计实验验证:取出少量右侧烧杯中溶液于试管中,
。设计实验验证:取出少量右侧烧杯中溶液于试管中,实验(三)测定Na2S∙xH2O产品纯度。
称取wg产品溶于水,配制成250mL溶液,准确量取25. 00mL溶液于锥形瓶中,加入V1mLc1mol·L-1I2溶液(过量),过滤,滴几滴淀粉溶液,用c2 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液V2mL。
(4)滴定终点的现象是
(5)滴定反应:Na2S+I2 =2NaI+S,I2 +2Na2S2O3 = Na2S4O6+ 2NaI。该产品含Na2S∙xH2O的质量分数为
 )是一种氰配合物,易溶于水,可检验
)是一种氰配合物,易溶于水,可检验 。某研究性学习小组拟制备铁氰化钾并探究其性质。
。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)制备铁氰化钾。用
 氧化
氧化 制备
制备 ,装置如图所示。
,装置如图所示。
 的体积小于Cu电极上生成气体的体积,其原因可能是
的体积小于Cu电极上生成气体的体积,其原因可能是②装置B中发生反应的化学反应方程式为
(2)探究铁氰化钾的性质。查阅资料,提出猜想:
猜想1:
 具有氧化性;
具有氧化性;猜想2:
 溶液中存在化学平衡
溶液中存在化学平衡 。
。设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知
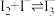 )。
)。| 实验 | 实验操作 | 实验现象 |
| Ⅰ | 向2mL饱和KI溶液中滴加5~6滴  溶液,振荡,再滴加几滴淀粉溶液 溶液,振荡,再滴加几滴淀粉溶液 | 无明显现象 |
| Ⅱ | 向2mL  溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液 | 溶液变成蓝色 |
| Ⅲ |   溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸 | 滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红 |
| Ⅳ | 向浓度均为  、 、 的混合溶液中放入一根无锈铁丝 的混合溶液中放入一根无锈铁丝 |  产生蓝色沉淀 产生蓝色沉淀 |
| Ⅴ | 向  溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) 溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同) | 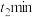 产生蓝色沉淀 产生蓝色沉淀 |
a.离子键 b.共价键 c.配位键
d.金属键 e.
 键 f.范德华力
键 f.范德华力②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是
(3)铁氰化钾可用于测定硫酸钴晶体
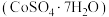 中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入
中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入 mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液
mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液 mL。反应的方程式为
mL。反应的方程式为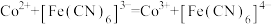 。样品中钴的含量
。样品中钴的含量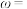
(4)铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途
4 . 保险粉(Na2S2O4)是一种白色粉末,在空气中易被氧化,在强酸性环境中不稳定,遇水自身易发生氧化还原反应。可用作还原剂和漂白剂。
I.实验室制法
将甲酸钠(易溶于水,微溶于甲醇)、80%甲醇水溶液和NaOH溶液混合,再通入SO2气体,并维持体系弱酸性环境。
(1)补全反应的化学方程式:HCOONa+NaOH+SO2=_____+CO2+_____,
(2)实验中采用80%甲醇水溶液的目的是
(3)反应一段时间后,装置中有白色固体析出,将固体过滤、洗涤、干燥、收集。干燥保险粉的最佳方法
a.空气中蒸发干燥b.真空干燥c.氯化氢气流中蒸发干燥
II.工业制法
(4)用惰性电极电解NaHSO3溶液制备Na2S2O4,装置如图所示。写出a电极的电极反应式

III.制备过程中,产生COD值很高的废水的处理方法
资料:COD为化学需氧量,是表示水中还原性物质多少的一个指标。是指在一定的条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。在Fe2+催化下,H2O2分解为具有强氧化性的氢氧自由基(·OH),可利用其氧化性氧化水体中的还原性物质,以达到处理COD值很高的废水的目的。
(5)用化学用语表示产生氢氧自由基(·OH)的过程
(6)当Fe2+投入量超过一定值,会使得还原性物质的脱除率降低,COD无法达到预期指标。可能的原因是
(1)工业上可以通过2KClO3+SO2=2ClO2+K2SO4的方法制取ClO2。
已知标准摩尔生成焓定义:在标准压力(100kPa)、一定温度下(通常298.15K),由元素最稳定的单质生成1mol纯物质B的反应焓变,叫做物质B的标准摩尔生成焓(△fH
 )。查找相关资料得知:
)。查找相关资料得知:| 物质 | KClO3(s) | SO2(g) | ClO2(g) | K2SO4(s) |
| 标准摩尔生成焓/(kJ·mol-1) | -397.7 | -396.8 | 102.5 | -1437.8 |
则2KClO3(s)+SO2(g)=2ClO2(g)+K2SO4(s) △H=
(2)消毒饮用水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去。控制其他条件不变,测得不同pH时Mn2+去除率随反应时间的变化如图甲。

①pH=8时ClO2转化为ClO
 ,该反应的离子方程式为
,该反应的离子方程式为②其他条件相同,水中Mn2+去除率随pH增大而增大,利用化学反应速率的相关知识分析,原因可能是
(3)还可利用ClO2的强氧化性来去除烟气中SO2等污染气体,涉及的部分反应如下:
Ⅰ. ClO2+SO2
 ClO+SO3
ClO+SO3Ⅱ.2ClO+2SO
 Cl2+2SO3
Cl2+2SO3两步反应的历程如图乙所示。
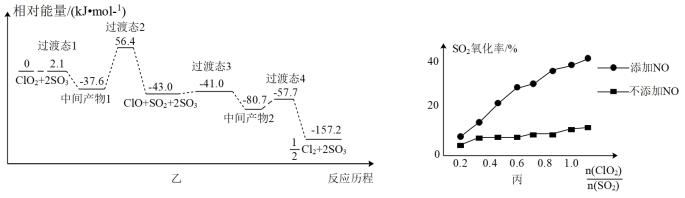
①该历程中最大活化能Ea=
②ClO2去除SO2效率较低,查找相关资料得知:反应Ⅰ的平衡常数K=5×10-34,反应Ⅱ的平衡常数K=0.11;ClO2也可去除污染气体NO,涉及的部分反应有Ⅲ.ClO2+NO=NO2+ClO、Ⅳ.2ClO+2NO=Cl2+2NO2。保持其他条件不变,对比添加NO、不添加NO两种情况,测得SO2氧化率随
 变化关系如图丙。不添加NO时,SO2氧化率较低的原因可能是
变化关系如图丙。不添加NO时,SO2氧化率较低的原因可能是(4)实验室中可用惰性电极电解酸性NaClO3溶液来制备少量的ClO2,电解装置如图丁所示。

电解一段时间后,产生ClO2的电极附近溶液的pH
(1)已知:①

 ②
②

则


(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
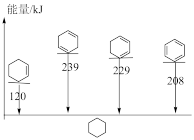
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)=  (l)的
(l)的
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式: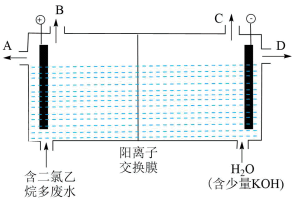
①
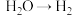 ;②
;②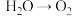 ;③
;③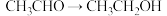 ;④
;④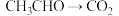 ;⑤
;⑤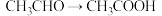 。
。下列说法错误的是
| A.发生反应②⑤的电极电势较另一电极更高 |
| B.乙醛既体现氧化性又体现还原性 |
C.当生成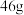 乙醇时,电路中转移 乙醇时,电路中转移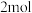 电子 电子 |
D.电解过程中,电极附近溶液的 :阴极 :阴极 阳极 阳极 |
湿法:
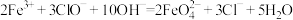
干法:

电解法:

下列选项中说法正确的是
| A.实验室中常用钾盐而不是钠盐原因是钠盐易风化导致固体结块 |
| B.物质的氧化性和还原性在水溶液中和非水体系中不一定相同 |
| C.坤cà和Nilky两人根据元素和化合物知识做出推断,坤ca:高铁酸钾在生活中可用于杀菌因为具有强氧化性;Nilky:高铁酸钾不可用作净水剂,因为高铁酸根不能水解生成胶体 |
| D.高铁酸根在酸性或中性溶液中分解,将生成气体收集在试管中,点燃的小木条靠近可以听到轻微的爆鸣声,且该气体在能源方面有很广泛的发展前景,常用于作清洁能源 |
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
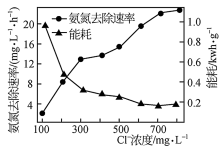
①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
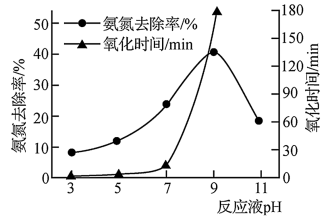
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是
 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:I.测定阿伏加德罗常数同时制得
 .实验装置如图所示:
.实验装置如图所示:
(2)烧杯中最终会看到
(3)在一定电流强度下电解一段时间,收集到的气体体积
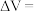
 (用含
(用含 的式子表示).将
的式子表示).将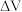 换算成标准状况下的体积记为
换算成标准状况下的体积记为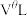 ,已知电路中通过的总电量为
,已知电路中通过的总电量为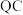 ,1个电子所带的电量为
,1个电子所带的电量为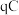 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
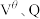 和q的表达式表示)。
和q的表达式表示)。Ⅱ.探究
 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: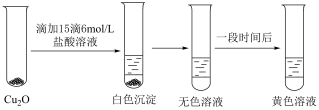
 白色,
白色,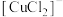 无色,
无色, 黄色.
黄色.(4)检验电解产物
 洗净需要用到的试剂是
洗净需要用到的试剂是(5)解释溶液颜色由无色变为黄色的原因
Ⅲ.测量电解产物
 的含量。
的含量。(6)称取
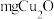 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)则测得电解产物中
 的含量为
的含量为 。
。



