名校
解题方法
1 . 下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
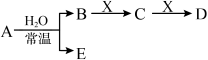
(1)⑧的元素符号是______ 。
(2)⑤与As两种元素中,非金属性较强的是______ (填元素符号)。
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是______________________ 。
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是________ 。
(5)若A为红棕色气体,则A、X、D的化学式分别为________ 、________ 、________ 。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
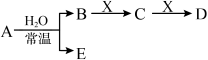
(1)⑧的元素符号是
(2)⑤与As两种元素中,非金属性较强的是
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是
(5)若A为红棕色气体,则A、X、D的化学式分别为
您最近一年使用:0次
名校
2 . 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是
元素符号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A.L2+与R2-的核外电子数相等 |
| B.M与L形成的最高价氧化物对应水化物的碱性:L>M |
| C.氢化物的稳定性为H2T<H2R |
| D.单质与等浓度的稀盐酸反应的速率为Q>L |
您最近一年使用:0次
2017-04-21更新
|
824次组卷
|
5卷引用:河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题
河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第一次月考化学试题2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
3 . 部分短周期元素的性质或原子结构如下表所示。
下列叙述不正确的是
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+ 7价 |
| A.原子半径:W>X>Y |
| B.化合物WY2不溶于水 |
| C.由X、Y和氢三种元素形成的所有化合物中只含共价键 |
| D.最高价氧化物对应水化物的酸性:W<Z |
您最近一年使用:0次
2017-04-20更新
|
798次组卷
|
7卷引用:河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题
名校
4 . 几种短周期元素的原子半径及主要化合价如下表所示:下列叙述不正确的是
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5-3 | -2 | +3 |
| A.离子半径大小:Y2+>M2+>R3 |
| B.Z与M组成的某种化合物能形成酸雨 |
| C.Y与M组成的化合物跟水反应后一定能得强酸 |
| D.X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
您最近一年使用:0次
名校
5 . 短周期元素X和Y,可组成化合物XY3。当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是
| A.①② | B.①②③ | C.①②③⑤ | D.①②④⑤ |
您最近一年使用:0次
2017-04-14更新
|
679次组卷
|
3卷引用:安徽省淮北市树人高级中学2020-2021学年高一下学期第一次阶段考试化学试题
名校
6 . 已知短周期元素的离子,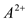 ,
, ,
, ,
,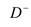 都具有相同的电子层结构,则下列叙述正确的是
都具有相同的电子层结构,则下列叙述正确的是
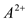 ,
, ,
, ,
,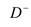 都具有相同的电子层结构,则下列叙述正确的是
都具有相同的电子层结构,则下列叙述正确的是| A.原子半径A>B>D>C | B.原子序数D>C>B>A |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
您最近一年使用:0次
2017-04-05更新
|
1507次组卷
|
2卷引用:2016-2017学年山东省济南第一中学高一3月阶段性考试化学试卷
名校
7 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
_________ 与盐酸反应最剧烈;________ 与盐酸反应的速度最慢;_________ 与盐酸反应产生的气体最多。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由___________ 。
II. 利用如图装置可验证同主族元素非金属性的变化规律。
(3)仪器B的名称为________ ,干燥管D的作用为_______ 。
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________ (填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______ 溶液吸收尾气。
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____ (填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________ 溶液的洗气瓶除去。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由
II. 利用如图装置可验证同主族元素非金属性的变化规律。
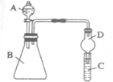
(3)仪器B的名称为
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液
您最近一年使用:0次
2017-04-01更新
|
586次组卷
|
2卷引用:2016-2017学年山东省枣庄市第八中学北校区高一下学期第一次月考化学试卷
8 . (I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第______ 周期,_____ 族,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式________ 。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________ 。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________ 。
(3)元素⑩的单质与⑦的氢化物高温下反应的化学方程式为___________ 。
(III)判断以下叙述正确的是__________ 。
部分短周期元素的原子半径及主要化合价
A. L2+、R2-的核外电子数相等
B. 单质与稀盐酸反应的速率L<Q
C. M与T形成的化合物一定具有两性
D. 氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中位于第
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
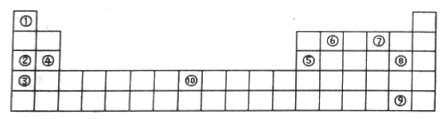
(1)元素⑦的氢化物与⑧的单质反应的离子方程式为
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为
(3)元素⑩的单质与⑦的氢化物高温下反应的化学方程式为
(III)判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A. L2+、R2-的核外电子数相等
B. 单质与稀盐酸反应的速率L<Q
C. M与T形成的化合物一定具有两性
D. 氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次
9 . 下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。
(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______ ,离子半径最小的是____ (写元素符号)。
(2)J的简单离子的结构示意图__________ 。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____ 。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______ (写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________ 。
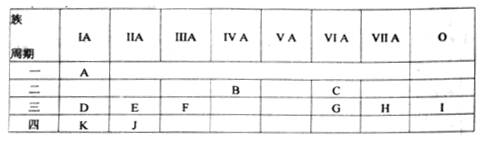
(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)
(2)J的简单离子的结构示意图
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)
(4)比较G、H两元素的最高价氧化物对应水化物的酸性
您最近一年使用:0次
10 . X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
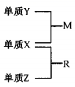
| A.X元素位于周期表中第16列 |
| B.X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物 |
| C.X、Y、Z元素形成的单质均具有强还原性 |
| D.R的沸点高于M的沸点 |
您最近一年使用:0次
2017-03-31更新
|
1387次组卷
|
4卷引用:四川省成都经济技术开发区实验中学校2019届高三上学期9月月考化学试题



