真题
名校
1 . 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理 的是
| A.第35号元素的单质在常温常压下是液体 |
| B.位于第四周期第ⅤA族的元素为非金属元素 |
| C.第84号元素的最高化合价是+7 |
| D.第七周期0族元素的原子序数为118 |
您最近一年使用:0次
2019-04-12更新
|
8271次组卷
|
38卷引用:安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题
安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题河北省正定中学2019-2020学年高一3月月考化学试题河北省承德市第一中学2019-2020学年高一下学期3月疫情期间直播课堂检测化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题06 物质结构 元素周期律——2019年高考真题和模拟题化学分项汇编浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题甘肃省天水市第一中学2020届高三上学期第五次(期末)考试化学试题(已下线)【南昌新东方】2019 新建一中 高三期中 015(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册第四章 物质结构 元素周期律 高考挑战区人教版(2019)高一必修第一册 第四章素养检测鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表 方法帮 高考帮(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题5 第一单元 元素周期律和元素周期表3(已下线)练习9 元素周期表-2020-2021学年【补习教材·寒假作业】高一化学(人教版)(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第五单元 物质结构与元素周期律(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)第14讲 元素周期律和元素周期表(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)专题07 元素周期表与元素周期律(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)
18-19高一下·山西·阶段练习
名校
2 . A、B两元素为ⅡA族和ⅢA族的元素,若A元素的原子序数为x,则B元素的原子序数可能为
①x+1 ②x+8 ③x+11 ④x-18 ⑤x+25 ⑥x+32
①x+1 ②x+8 ③x+11 ④x-18 ⑤x+25 ⑥x+32
| A.①②③④ | B.①③⑥ | C.①③⑤ | D.②④⑥ |
您最近一年使用:0次
名校
3 . A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若 A 元素的原子序数为 a,则 B 元素的原子序数可能为( )
| A.a-4 | B.a-5 | C.a-6 | D.a+4 |
您最近一年使用:0次
2019-04-09更新
|
397次组卷
|
3卷引用:【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题
名校
4 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
| A.W元素和X元素形成的化合物WX2属于非极性分子 |
| B.工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y |
| C.制造日常生活中所使用的计算机芯片需要消耗大量单质Z |
| D.X元素和R元素形成的某种化合物可用于自来水的消毒 |
您最近一年使用:0次
2019-03-24更新
|
1522次组卷
|
5卷引用:【全国百强校】湖南省长沙市雅礼中学2019届高三上学期月考(五)化学试题
【全国百强校】湖南省长沙市雅礼中学2019届高三上学期月考(五)化学试题河北省石家庄实验中学2019-2020学年高一3月月考化学试题湖北省襄阳市第一中学2019-2020学年高二下学期四月月考化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)
名校
解题方法
5 . 已知X、Y、Z、W 为短周期主族元素,在元素周期表中的相对位置如下图所示,其中Z元素原子之间通常形成Z2分子。下列说法不正确的是
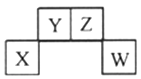

| A.X元素的单质既能与强酸反应也能与强碱反应 |
| B.Y元素形成的氢化物在常温下不一定为气体 |
| C.W元素的最高价氧化物对应水化物一定为强酸 |
| D.由Y、Z、W 三种元素形成的二元化合物中只含共价键 |
您最近一年使用:0次
2018-05-11更新
|
1957次组卷
|
4卷引用:【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题
名校
6 . 具有以下结构的原子一定属于p区元素的是( )
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
| A.②③ | B.①③ |
| C.②④ | D.①④ |
您最近一年使用:0次
2018-05-02更新
|
785次组卷
|
7卷引用:贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题
名校
7 . (1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
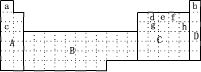
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________ (填名称),可以验证该结论的实验是_______ 。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______ ,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________ (用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:
(4)上表中c、h元素形成的简单离子半径之比
您最近一年使用:0次
2018-04-13更新
|
505次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2017-2018学年高一4月月考化学试题1
名校
解题方法
8 . 有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位的为铜、铝、铅、锌、镍。回答下列问题。
(1)铜原子的电子占有________ 种能量不同的原子轨道;在元素周期表中铝和铅元素处于周期表的_____ 区。
(2)配合物分子内(如图)的化学键有____________ (填序号)。
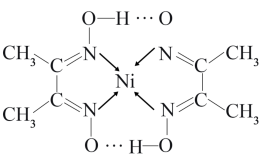
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________ (填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________ 形。
(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“ ”表示)和硫原子(用空心圆点“O”表示)的位置。
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________

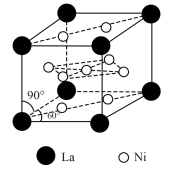
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是__________ (填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为_______________ 。若每个晶胞可吸收3个H2,则储氢后(氢进入晶胞空隙,体积不变)该晶胞的密度计算式为___________________________ 。(NA表示阿伏伽德罗常数)
(1)铜原子的电子占有
(2)配合物分子内(如图)的化学键有

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH
 CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“
 ”表示)和硫原子(用空心圆点“O”表示)的位置。
”表示)和硫原子(用空心圆点“O”表示)的位置。
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为

您最近一年使用:0次
名校
9 . A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为_______ ;
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为____ ;
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为___________ ;
(4)D元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为______ 。
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期
表中所处的周期数和族序数:____________________ .
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为
(4)D元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期
表中所处的周期数和族序数:
您最近一年使用:0次
2017-11-02更新
|
541次组卷
|
2卷引用:内蒙古集宁一中2017-2018学年高二下学期第二次月考理科考试综合化学试题
名校
10 . 下列说法正确的是
| A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6 |
| B.所有的非金属元素都分布在p区 |
| C.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子的化学性质相似 |
| D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称过渡金属元素 |
您最近一年使用:0次
2017-11-01更新
|
1501次组卷
|
5卷引用:安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题
安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期末考试化学试题(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)



