名校
解题方法
1 . 下列说法错误的是( )
| A.X和Y两种元素为同一周期第IIA族和第IIIA族元素,若X的原子序数为x,则Y的原子序数可能为x+1,x+11, x+25 |
| B.短周期元素Z和W组成化合物ZW3,若W的原子序数为x,Z的原子序数不可能是x+14 |
| C.短周期元素Q和M组成化合物Q2M,Q和M所在的族序数可能为VA和第VIA |
| D.利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 |
您最近一年使用:0次
2020-09-15更新
|
1383次组卷
|
6卷引用:吉林省长春市东北师范大学附属中学2019-2020学年高一下学期阶段考试化学试题
吉林省长春市东北师范大学附属中学2019-2020学年高一下学期阶段考试化学试题山东省实验中学2022-2023学年高一下学期3月月考化学试题山东省青岛市平度第一中学2023-2024学年高一下学期4月月考化学试题(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题16 元素周期律和元素周期表(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
2 . A、B、C是短周期ⅠA和ⅡA族元素的碳酸正盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:___ 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式___ 。
(3)A的正确选择有___ 种,其化学式为:___ 。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式
(3)A的正确选择有
您最近一年使用:0次
解题方法
3 . 如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
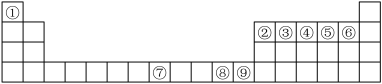
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________ 区。
(2)④、⑥两元素形成的化合物的立体构型为________ ,其中心原子的杂化轨道类型为________ 。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________ 。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________ 。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____ ,写出与化合物A互为等电子体的一种阳离子______ (填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______ (填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________ 晶体(填晶体类型),化合物中⑦的化合价为:_______ 。根据等电子体理论,该化合物的配体的结构式为:_______ ,CaC2中,阴离子的电子式为: ____________________ 。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的
(2)④、⑥两元素形成的化合物的立体构型为
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次
4 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
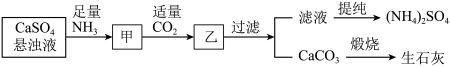
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
解题方法
5 . 有X、Y、Z、W四种短周期主族元素,它们在周期表中的位置如图所示,已知Y是地壳中含量最高的金属元素,则下列说法中正确的是( )
| X | |||
| Y | Z | W |
| A.简单离子半径:Y>W |
| B.Y的最高价氧化物的水化物和X的最高价氧化物的水化物可反应 |
| C.X的简单氢化物比Z的简单氢化物更稳定、沸点更高 |
| D.非金属性:W>X |
您最近一年使用:0次
2019-12-31更新
|
559次组卷
|
3卷引用:华南师范大学附中2020届高三上学期第三次月考理综化学试题
名校
6 . 根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是_____ ,只有负价而无正价的是_____ ,氧化性最强的单质是____ ;
(2)最高价氧化物的水化物碱性最强的是_____ ,酸性最强的是_____ ,呈两性的是_____ ;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____ ;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____ ;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______ 可以验证该结论的实验是_ 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物碱性最强的是
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2019-10-25更新
|
118次组卷
|
2卷引用:上海外国语大学附属外国语学校2017-2018学年高二12月月考化学试题
解题方法
7 . W、X、Y、Z为原子序数依次递增的短周期主族元素,W的单质是同条件下密度最小的气体,X、Y、Z为同一周期紧邻元素,M、R为同一主族的元素,M的单质常温为液态,R的单质常温为固态,且易升华。回答下列问题:
(1)写出下列元素的名称:W___ ;M____ 。
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:___ ;X、Y、Z的简单氢化物的沸点由高到低的顺序为__ (写化学式)。
②上述反应的离子方程式为___ 。
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,__ (填“能”或“不能”)发生,其原因是____ 。
②请写出R2与含YO32-溶液反应的离子方程式为____ 。
(1)写出下列元素的名称:W
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:
②上述反应的离子方程式为
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,
②请写出R2与含YO32-溶液反应的离子方程式为
您最近一年使用:0次
2019-09-26更新
|
387次组卷
|
2卷引用:学科网2019年高三11月大联考(样卷)化学试题
名校
8 . X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
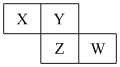

A.Y的价层电子排布式是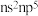 |
| B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物 |
| C.Y、Z之间可形成离子型化合物 |
| D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸 |
您最近一年使用:0次
2019-08-13更新
|
1538次组卷
|
5卷引用:新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题
9 . 下列说法正确的是
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22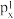 →1s22s22 →1s22s22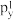 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区 |
您最近一年使用:0次
2019-07-15更新
|
2342次组卷
|
7卷引用:福建省宁德市柘荣县第一中学2021-2022学年高二下学期月考八化学试题
名校
10 . W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
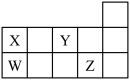

| A.四种元素中原子半径最大的为Z |
| B.四种元素最高价氧化物的水化物都是酸 |
| C.XZ4、WY2中所含化学键类型相同 |
| D.W、X形成的单质都是重要的半导体材料 |
您最近一年使用:0次
2019-06-29更新
|
740次组卷
|
5卷引用:【新东方】高中化学5030



