如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
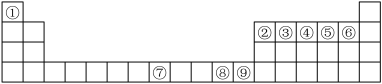
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________ 区。
(2)④、⑥两元素形成的化合物的立体构型为________ ,其中心原子的杂化轨道类型为________ 。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________ 。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________ 。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____ ,写出与化合物A互为等电子体的一种阳离子______ (填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______ (填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________ 晶体(填晶体类型),化合物中⑦的化合价为:_______ 。根据等电子体理论,该化合物的配体的结构式为:_______ ,CaC2中,阴离子的电子式为: ____________________ 。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的
(2)④、⑥两元素形成的化合物的立体构型为
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
更新时间:2020-03-24 15:27:22
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】为纪念DmitriMendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会宣布2019年是“国际化学元素周期表年”。以下是元素周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是___________ 。
(2)最高价氧化物的水化物中酸性最强的是___________ 。
(3)元素B原子核外有___________ 种能量不同的电子,基态C原子最高能级电子云形状是___________ 。
(4)比较元素的金属性:B___________ C(填“>”或“<”),从原子结构的角度说明理由___________ 。
(5)A分别与E、G、H形成的化合物中,最稳定的是___________
(6)检验B元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有___________ (填“极性”或“非极性”)共价键,若将其投入硫酸亚铁溶液中,预测主要的反应现象是___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | A | ||||||||
| 2 | D | E | G | ||||||
| 3 | B | C | J | H | I |
(2)最高价氧化物的水化物中酸性最强的是
(3)元素B原子核外有
(4)比较元素的金属性:B
(5)A分别与E、G、H形成的化合物中,最稳定的是
(6)检验B元素的方法是
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
上述科学家的研究按照时间先后排序合理的是__________ (填数字序号)。
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
(1)门捷列夫将已有元素按照相对原子质量排序,同一__________ (填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是__________ ,第5列方框中“Te=128?”的问号表达的含义是__________ 。
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是__________ (填字母序号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________ ,元素Z的离子结构示意图为__________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__________ 。
(3)元素W位于周期表的第__________ 族,其非金属性比元素R弱,用原子结构的知识解释原因____________________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________________ 。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】如表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为________ 。
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是________ (填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________ (填化学式)。
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为________ 。②④两种元素形成的原子数目比为1:2的共价化合物的结构式为________ 。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为________ 。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】回答下列问题:
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为___ ,原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为___ 。
②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=____ 。
③碲和硫同主族,TeO 的空间构型为
的空间构型为___ ,写出一个与TeO 互为等电子体的分子
互为等电子体的分子___ 。
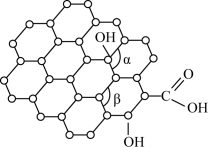
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为___ ;石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角α___ (填“>”、“<”或“=”)键角β,原因是___ 。
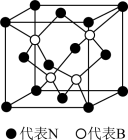
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的___ (填“四面体”、“八面体”或“立方体”)空隙中。若晶胞边长为apm,B原子半径为bpm,N原子半径为cpm,则该晶胞的空间利用率为____ (列出计算式),氮硼原子间的最短距离为___ pm。
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=
③碲和硫同主族,TeO
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为

(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
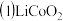 、
、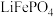 常用作锂离子电池的正极材料。
常用作锂离子电池的正极材料。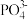 的空间构型为
的空间构型为____________ 基态Co原子核外电子排布式为____________ ,第四电离能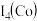
______ 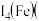 填“
填“ ”或
”或 ”
” ,原因是
,原因是________________ 。
 铁系元素能与CO形成
铁系元素能与CO形成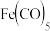 、
、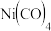 等金属羰基配合物。
等金属羰基配合物。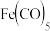 中与Fe形成配位键的是
中与Fe形成配位键的是______  填“碳”或“氧”
填“碳”或“氧” 原子。与CO互为等电子体的是
原子。与CO互为等电子体的是_________  任写一种即可
任写一种即可 。在CO分子中,
。在CO分子中, 键与
键与 键数目之比为
键数目之比为________ 。
 铁与
铁与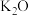 、
、
 环戊二烯
环戊二烯 在隔绝空气条件下共热可制得二茂铁
在隔绝空气条件下共热可制得二茂铁 。在环戊二烯中,C原子的杂化轨道类型为
。在环戊二烯中,C原子的杂化轨道类型为______ 。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华,则它的晶体类型是___________ 。
 铁单质的堆积方式有两种,其中一种剖面图如图所示:
铁单质的堆积方式有两种,其中一种剖面图如图所示:
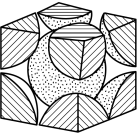
在此堆积方式里,铁原子的半径为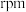 ,则其晶胞棱长为
,则其晶胞棱长为_______________ cm。
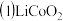 、
、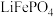 常用作锂离子电池的正极材料。
常用作锂离子电池的正极材料。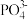 的空间构型为
的空间构型为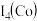
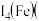 填“
填“ ”或
”或 ”
” ,原因是
,原因是 铁系元素能与CO形成
铁系元素能与CO形成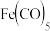 、
、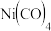 等金属羰基配合物。
等金属羰基配合物。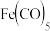 中与Fe形成配位键的是
中与Fe形成配位键的是 填“碳”或“氧”
填“碳”或“氧” 原子。与CO互为等电子体的是
原子。与CO互为等电子体的是 任写一种即可
任写一种即可 。在CO分子中,
。在CO分子中, 键与
键与 键数目之比为
键数目之比为 铁与
铁与 、
、
 环戊二烯
环戊二烯 在隔绝空气条件下共热可制得二茂铁
在隔绝空气条件下共热可制得二茂铁 。在环戊二烯中,C原子的杂化轨道类型为
。在环戊二烯中,C原子的杂化轨道类型为 铁单质的堆积方式有两种,其中一种剖面图如图所示:
铁单质的堆积方式有两种,其中一种剖面图如图所示: 
在此堆积方式里,铁原子的半径为
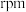 ,则其晶胞棱长为
,则其晶胞棱长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】碳、氮和磷元素是几乎所有的生物体中均含有的生命元素。回答下列问题:
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和 ,分子中的大Π键可用符号
,分子中的大Π键可用符号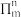 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为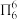 ,则
,则 中的大Π键应表示为
中的大Π键应表示为__________________ 。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以 和
和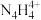 两种离子的形式存在。
两种离子的形式存在。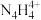 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测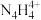 的结构式:
的结构式:_______________________ 。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:____________________________ 。
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
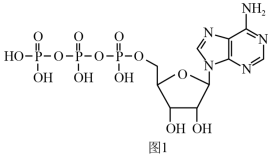 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有_______________ 个。
(5)某种磁性氮化铁的晶胞结构如图2所示。

①基态Fe原子的电子排布式为______________________ 。
②该化合物的化学式为___________________________ 。
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为__________________ g.cm-3(用含a、c、NA的代数式表示)。
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和
 ,分子中的大Π键可用符号
,分子中的大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为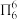 ,则
,则 中的大Π键应表示为
中的大Π键应表示为(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以
 和
和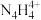 两种离子的形式存在。
两种离子的形式存在。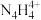 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测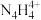 的结构式:
的结构式:(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有(5)某种磁性氮化铁的晶胞结构如图2所示。

①基态Fe原子的电子排布式为
②该化合物的化学式为
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】有机一无机杂化铅卤钙钛矿(CH3NH3PbI3 )作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。
(1)Pb位于第六周期IV A族,其基态原子的价电子排布图为_______ 。
(2)CH3NH3PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (填元素符号)。沸点:CH4_______ (填“ 高于”或“低于”)NH3,原因是_______ 。
(3)有机阳离子CH3NH 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ ; 的立体构型为
的立体构型为_______ 。
(4)CH3NH3PbI3的立方晶胞结构如图所示,晶胞中1个Pb2+周围距离最近的I—数目为_______ , 已知晶胞边长为a pm,则CH3NH 与I—之间最短的距离为
与I—之间最短的距离为_______ pm,CH3NH3PbI3的摩尔质量为Mg·mol-1,NA为阿伏加德罗常数的值,则CH3NH3PbI3晶胞的密度为_______ (用含a、M、NA的代数式表示)g·cm-3。

(1)Pb位于第六周期IV A族,其基态原子的价电子排布图为
(2)CH3NH3PbI3中涉及的短周期元素的电负性由大到小的顺序为
(3)有机阳离子CH3NH
 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是 的立体构型为
的立体构型为(4)CH3NH3PbI3的立方晶胞结构如图所示,晶胞中1个Pb2+周围距离最近的I—数目为
 与I—之间最短的距离为
与I—之间最短的距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】(1)Co、Cu、Zn都是过渡元素,可作为中心原子形成多种配合物,下列不能作为配合物配位体的是______ ;
A.H2O B.NH3 C.CH4 D.Cl﹣
(2)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键____ ;
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有______ (填序号);
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
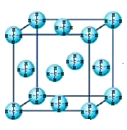
(4)甲烷晶体的晶胞结构如下图,下列有关说法正确的是_______ 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
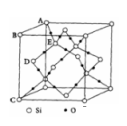
(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含______ mol Si-O键。如果该立方体的边长为a cm,用NA 表示阿伏伽德罗常数,则SiO2晶体的密度表达式为__________________ g/cm3 。
A.H2O B.NH3 C.CH4 D.Cl﹣
(2)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)甲烷晶体的晶胞结构如下图,下列有关说法正确的是
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键

(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
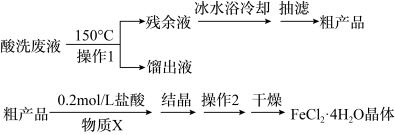
【推荐3】镀锌钢构件的酸洗废液中含有2.5mol。L-1盐酸、50%FeCl2·4H2O和2%ZnCl2。实验室从酸洗废液中回收盐酸和FeCl2·4H2O的实验流程如下:
回答下列问题:
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择___________ (填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能___________ 。
②如果残余液过多,可能会导致___________ 。(答一条)
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是___________ 。
(4)重结晶前加入的物质X为___________ ;操作2的名称是___________ 。
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为___________ %(用含a、c的最简代数式表示)。
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。___________ 。
②亚甲基蓝中N原子的杂化方式有___________ 。
③DMA的碱性比苯胺强,说明理由___________ 。
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| FeCl2 | 49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 |
| ZnCl2 | 342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
I.回收盐酸和FeCl2·4H2O粗产品
(1)操作1应选择
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl2·4H2O粗产品,应加热至留有少量残余液时立即停止。
①立即停止可以避免Fe2+被氧化外,还能
②如果残余液过多,可能会导致
Ⅱ.FeCl2·4H2O粗产品的重结晶
(3)检验FeCl2·4H2O粗产品中含有Fe3+的操作方法是
(4)重结晶前加入的物质X为
Ⅲ.滴定亚铁离子,测定FeCl2·4H2O晶体纯度
准确称取ag重结晶后的FeCl2·4H2O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指示剂,用cmol。L-1K2Cr2O7标准溶液滴定至终点,半分钟内不恢复原色,消耗K2Cr2O7标准溶液平均体积为VmL(此时Cl-不被氧化)。(M【FeCl2·4H2O】=199 g·mol-1)
(5)计算FeCl2·4H2O晶体的纯度为
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。

②亚甲基蓝中N原子的杂化方式有
③DMA的碱性比苯胺强,说明理由
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。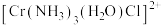 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)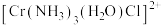 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和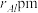 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
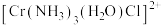 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
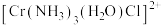 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和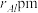 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)Co3+的价电子排布图为:___ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:___ 。
(3)写出一种与PO 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___ ,该分子的中心原子的价层电子对数等于___ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:___ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:___ 。
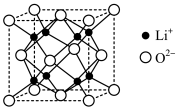
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:___ ,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为___ g·cm-3(列出计算式即可),O2-和Li+的最短距离等于__ nm(用含b的代数式表示)。
(1)Co3+的价电子排布图为:
(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与PO
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】ⅢA族元素能与其他元素组成结构、性质各异的化合物。回答下列问题:
(1)基态B原子核外电子的运动状态有___________ 种,基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为___________ 。
(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物是最早的媒染染料。
生成的红色配合物是最早的媒染染料。
①茜素水溶性较好的原因是___________ 。
② 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有___________  。
。


(3) (氨硼烷)是具有潜力的化学储存材料之一,
(氨硼烷)是具有潜力的化学储存材料之一, 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应:
的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应: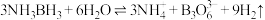 ,
, 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由___________ 变为___________ 。
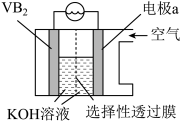
(4)硼化钒 ——空气电池的示意图如图所示,该电池工作时发生反应:
——空气电池的示意图如图所示,该电池工作时发生反应: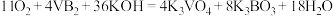 ,负极电极反应式为
,负极电极反应式为___________ ,为使电池工作效率最大化,则选择性透过膜为___________ 离子透过膜(填“阴”或“阳”)。
(1)基态B原子核外电子的运动状态有
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 、
、 生成的红色配合物是最早的媒染染料。
生成的红色配合物是最早的媒染染料。①茜素水溶性较好的原因是
②
 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有 。
。


(3)
 (氨硼烷)是具有潜力的化学储存材料之一,
(氨硼烷)是具有潜力的化学储存材料之一, 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应:
的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应: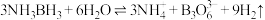 ,
, 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(4)硼化钒
 ——空气电池的示意图如图所示,该电池工作时发生反应:
——空气电池的示意图如图所示,该电池工作时发生反应: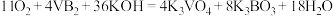 ,负极电极反应式为
,负极电极反应式为
您最近一年使用:0次



