名校
解题方法
1 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:___________ ,其在元素周期表中的位置___________ 。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(3)o、p两元素的部分电离能数据如表2:
比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________ 。
(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是___________ (填元素符号),e的价电子排布图为___________ 。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)元素p为26号元素,请写出其基态原子的核外电子排布式:
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据如表2:
元素 电离能(kJ/mol) | o | p |
| 717 | 759 |
| 1509 | 1561 |
| 3248 | 2957 |
比较两元素的
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(4)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是
您最近一年使用:0次
名校
解题方法
2 . (I)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置为:_______ ,属于_______ 元素(填“金属”或“非金属”)。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
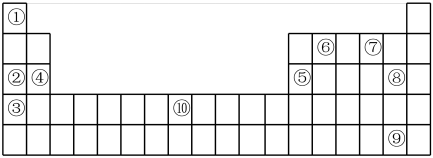
(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是_______ (填化学式)。
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为_______ ;
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为_______ ;
(5)元素⑩的名称为_______ ,其单质与⑧的单质反应的化学方程式为_______ ;
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是_______
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中的位置为:
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为
(5)元素⑩的名称为
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次
3 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的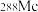 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为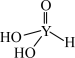 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
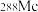 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
661次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
4 . 下列关于元素周期表及周期律的叙述,其中错误的是
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
2023-03-17更新
|
932次组卷
|
4卷引用:山东省德州市第一中学2022-2023学年高一3月月考化学试题
山东省德州市第一中学2022-2023学年高一3月月考化学试题山东省德州市2022-2023学年高一下学期3月月考化学试题湖北省沙市中学2022-2023学年高一下学期4月期中考试化学试题(已下线)第17讲 元素周期律-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
名校
解题方法
5 . 硼氢化钠(NaBH4)具有很强的还原性,被称为“万能还原剂”,NaBH4在催化剂钌(44Ru)表面与水反应的历程如图所示:
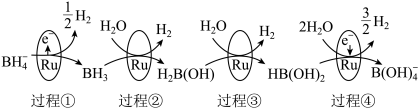
| A.元素钌(44Ru)位于d区 |
| B.BH3分子的空间结构和VSEPR模型不同 |
| C.过程④中产生1molH2,转移电子物质的量为2mol |
| D.硼氢化钠中硼元素的化合价为+3价,反应过程中硼元素的化合价始终保持不变 |
您最近一年使用:0次
2023-03-16更新
|
342次组卷
|
3卷引用:山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
6 . 短周期主族元素X、Y、Z、W在周期表中位置如图,下列表述正确的是
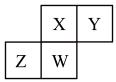

| A.Y最高正价可能为+6价 |
| B.W有可能周期数等于其族序数 |
| C.Z的最高价氧化物有可能与Y的最高价氧化物对应的水化物反应 |
| D.若X为氧元素,则离子半径顺序:r(W2-)>r(Y-)>r(X2-)>r(Z3-) |
您最近一年使用:0次
2023-02-16更新
|
791次组卷
|
2卷引用:山东省东明县第一中学2022-2023学年高一下学期3月月考化学试题
名校
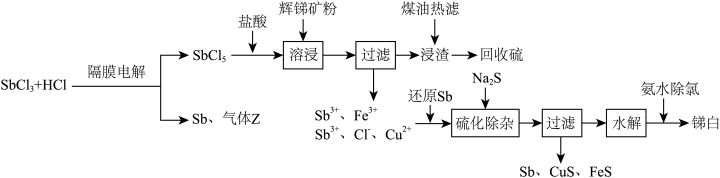
7 . 三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
及少量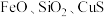 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,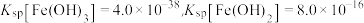 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
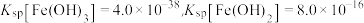 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
2023-02-03更新
|
424次组卷
|
2卷引用:湖南省祁阳市第一中学2023届高三月考(六)化学试题
名校
解题方法
8 . 短周期元素W、X、Y、Z、Q,原子序数依次增大,W原子没有中子,X元素为地壳中含量最多的元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,下列结论不正确的是
| A.原子半径大小顺序为Y>Z>Q>X>W |
| B.W、X、Y形成的化合物中只有共价键 |
| C.X、Y可以形成的原子个数比1:1或1:2的化合物 |
| D.最高价氧化物对应的水化物酸性Z﹤Q |
您最近一年使用:0次
2023-01-12更新
|
1063次组卷
|
4卷引用: 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题
山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题山东省青岛第十九中学2022-2023学年高一4月月考化学试题江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
9 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
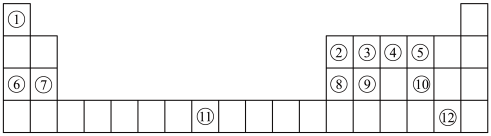
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
340次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
名校
10 . 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的Cd2+配合物的结构如图所示,则下列说法正确的是
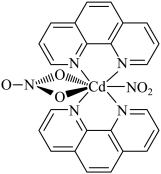

| A.该螯合物中N的杂化方式有2种 |
| B.1mol该配合物中通过螯合作用形成的配位键有6mol |
| C.Cd属于d区元素 |
| D.Cd的价电子排布式为4d85s2 |
您最近一年使用:0次
2022-11-07更新
|
932次组卷
|
3卷引用:湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题




