名校
1 . 三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
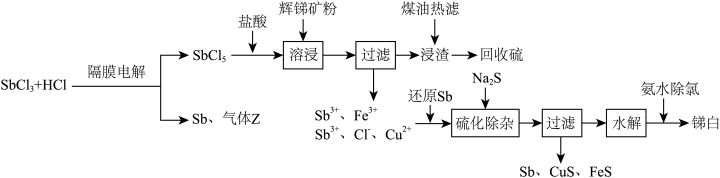
及少量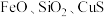 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,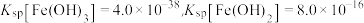 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量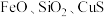 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
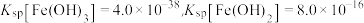 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
2023-02-03更新
|
436次组卷
|
2卷引用:湖南省祁阳市第一中学2023届高三月考(六)化学试题
名校
解题方法
2 . 短周期元素W、X、Y、Z、Q,原子序数依次增大,W原子没有中子,X元素为地壳中含量最多的元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,下列结论不正确的是
| A.原子半径大小顺序为Y>Z>Q>X>W |
| B.W、X、Y形成的化合物中只有共价键 |
| C.X、Y可以形成的原子个数比1:1或1:2的化合物 |
| D.最高价氧化物对应的水化物酸性Z﹤Q |
您最近一年使用:0次
2023-01-12更新
|
1098次组卷
|
4卷引用: 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题
山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题山东省青岛第十九中学2022-2023学年高一4月月考化学试题江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
3 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
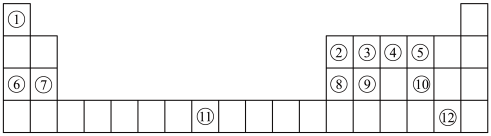
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
359次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
名校
4 . 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的Cd2+配合物的结构如图所示,则下列说法正确的是
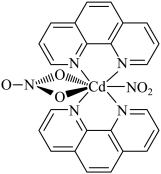

| A.该螯合物中N的杂化方式有2种 |
| B.1mol该配合物中通过螯合作用形成的配位键有6mol |
| C.Cd属于d区元素 |
| D.Cd的价电子排布式为4d85s2 |
您最近一年使用:0次
2022-11-07更新
|
964次组卷
|
3卷引用:湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
5 . 某固态结晶水合物 X 由 5 种元素组成。某学习小组进行了如下实验:
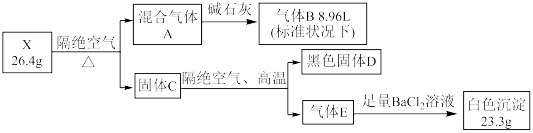
已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置___________
(2)气体 B 的实验方法是___________
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:___________
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为___________ g

已知气体B能与 AgNO3 溶液反应, D中两种元素质量比为4:1 ,请回答:
(1)上述五种元素中,写出原子序数最大的元素在周期表中的位置
(2)气体 B 的实验方法是
(3)写出 X 在隔绝空气条件下加热,生成 A 、D 、E 的化学方程式:
(4)已知气体B和固体D加热时会发生反应,产物中有两种单质,当参加反应的 D 质量是1.2g时,所生成的两种单质的质量差为
您最近一年使用:0次
名校
解题方法
6 . 砷(As)的某些化合物具有独特的性质与用途,如 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 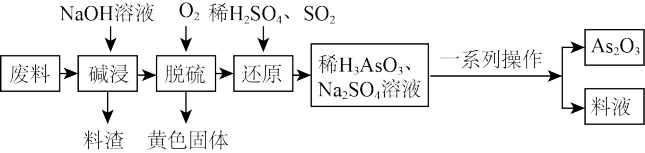
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是_______ ,从物质化学性质角度看, 不可能是
不可能是_______ (填“酸”、“碱”或“两”)性氧化物。
(2)碱浸液中溶质主要为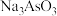 和
和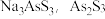 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:_______ 。
(3)脱硫后以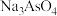 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。还原后砷以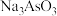 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(4)还原后加热溶液,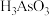 分解为
分解为 ,结晶得到相
,结晶得到相 ,
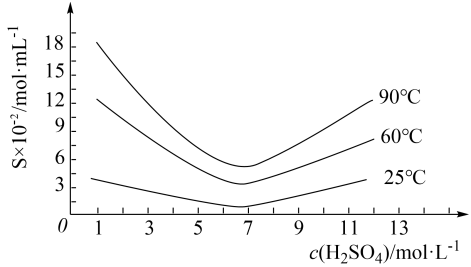
, 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_______ 。
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是_______ 。
 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是
 不可能是
不可能是(2)碱浸液中溶质主要为
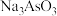 和
和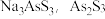 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:(3)脱硫后以
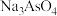 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式: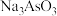 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(4)还原后加热溶液,
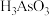 分解为
分解为 ,结晶得到相
,结晶得到相 ,
, 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是
您最近一年使用:0次
2022-10-12更新
|
359次组卷
|
2卷引用:山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题
名校
7 . 一种从废弃SCR催化剂(主要含78%TiO2、V2O5及SiO2、Al2O3等)中回收钛、钒的工艺流程如图所示:

(1)Ti在周期表中的位置是_____________ ,价层电子排布式是________________ 。
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO +H2O、
+H2O、__________ 、___________ 。
(3)沉淀X的主要成分是H2SiO3、_________ (填化学式)。
(4)在焙烧NH4VO3时,气体产物经过与_______ (填化学式)反应后,可以在生产流程中循环利用。
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
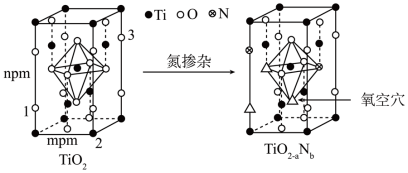
已知原子1、2的分数坐标为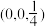 和
和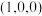 ,则原子3的坐标分别为
,则原子3的坐标分别为______ ,设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。TiO2-aNb晶体中a=_______ 。

(1)Ti在周期表中的位置是
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO
 +H2O、
+H2O、(3)沉淀X的主要成分是H2SiO3、
(4)在焙烧NH4VO3时,气体产物经过与
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

已知原子1、2的分数坐标为
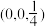 和
和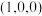 ,则原子3的坐标分别为
,则原子3的坐标分别为
您最近一年使用:0次
8 . 据Nature Energy报道,最近科研人员研制出一种低浓度锂盐水系电解质溶液,充放电过程中锂离子具有较高的扩散速率,使得锂离子电池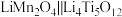 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。
(1)对电极材料组成元素的分析。
①O原子核外电子有___________ 种运动状态。
②Mn元素位于元素周期表的___________ 区。
③基态Ti原子的核外电子排布式为___________ 。
(2)将 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。
①该反应的化学方程式为___________ 。
② 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和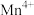 的含量与温度的关系见下表。
的含量与温度的关系见下表。
在上述温度范围内,锰元素平均价态的变化趋势为___________ 。
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂( )。
)。
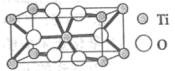
①Ti的氧化物晶胞结构如图所示,其化学式为___________ 。
②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(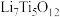 ),则正极的电极反应式为
),则正极的电极反应式为___________ 。
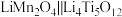 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。(1)对电极材料组成元素的分析。
①O原子核外电子有
②Mn元素位于元素周期表的
③基态Ti原子的核外电子排布式为
(2)将
 和
和 按
按 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。①该反应的化学方程式为
②
 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和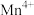 的含量与温度的关系见下表。
的含量与温度的关系见下表。| T/℃ | 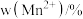 | 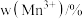 | 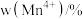 |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(
 )。
)。①Ti的氧化物晶胞结构如图所示,其化学式为

②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(
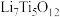 ),则正极的电极反应式为
),则正极的电极反应式为
您最近一年使用:0次
2022-06-29更新
|
236次组卷
|
2卷引用:江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
9 . 如图为元素周期表的一部分。请回答下列问题。
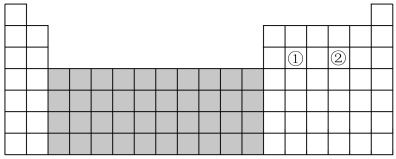
(1)图中阴影部分所示区域的元素称为____ 元素,下列元素属于该区域的是____ (填字母)。
A.Ba B.Fe C.Br D.Rb
(2)已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如表:
写出D元素在元素周期表中的位置____ 。
(3)C的最高价氧化物与E的单质在点燃条件下发生反应的化学方程式为____ ;由F的化合物生成A的单质的化学方程式为____ 。
(4)C与氢元素可组成一种气体,该气体在标准状况下的密度为1.25g•L-1,该气体的摩尔质量为____ 。
(5)下列说法不正确 的是____ 。
(6)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式____ 。

(1)图中阴影部分所示区域的元素称为
A.Ba B.Fe C.Br D.Rb
(2)已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如表:
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
(3)C的最高价氧化物与E的单质在点燃条件下发生反应的化学方程式为
(4)C与氢元素可组成一种气体,该气体在标准状况下的密度为1.25g•L-1,该气体的摩尔质量为
(5)下列说法
| A.元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 |
| B.第5周期第ⅤA族元素的原子序数为65 |
| C.②形成的最简单氢化物比①形成的最简单氢化物的稳定性高 |
| D.周期表中当某元素的周期序数大于其族序数时,该元素可能属于金属或非金属 |
您最近一年使用:0次
10 . 废锂离子电池回收是对“城市矿产”的资源化利用,可促进新能源产业链闭环。废磷酸铁锂粉主要成分为LiFePO4,还含有的杂质为Al、Cu、Mg.回收LiCl的工艺流程如下:
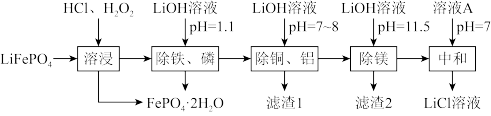
已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为_______ ,Fe在周期表中的位置为_______ 。
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:_______ ;生成FePO4·2H2O的离子反应方程式:_______ 。
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=_______ ,若溶液中的c(Li+)=1mol/L,不考虑其他离子参与反应,为使Li+不转化为Li3PO4沉淀,则pH需小于_______ 。
(4)溶液A为_______ ,若最终获得LiCl溶液的体积为aL,其中Li+的密度为pg·L-1,废磷酸铁锂粉中Li元素的质量为mg,三次加入的LiOH溶液中溶质LiOH的总质量为m1g,其利用率为α,求废磷酸铁锂粉中Li元素的回收率x(Li)=_______ ×100%。(列出计算式即可,不用化简)

已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=
(4)溶液A为
您最近一年使用:0次



