名校
解题方法
1 . 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确 的是
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A.原子半径:丁>戊>乙 |
| B.乙的简单氢化物的沸点一定高于戊的简单氢化物的沸点 |
| C.甲的简单氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
名校
解题方法
2 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
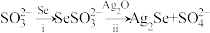
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
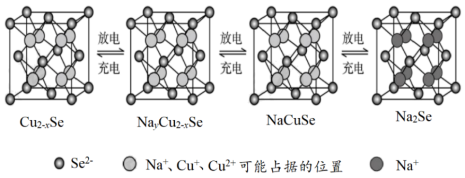
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: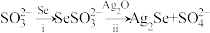
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
428次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
名校
解题方法
3 . 已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
| Y | ||
| X | ||
| Z |
| A.Y的原子序数可能为a-17 | B.Y与Z的原子序数之和可能为2a |
| C.Z的原子序数可能为a+31 | D.X、Y、Z可能均为短周期元素 |
您最近一年使用:0次
2023-06-18更新
|
963次组卷
|
8卷引用:四川省成都市外国语学校2018-2019学年高二上学期入学考试化学试题
名校
4 . 几种主族元素在周期表中的位置如下:
根据上表回答下列问题:
(1)画出⑩的原子结构示意图:_______ 。
(2)④和⑨两种元素形成的化合物的电子式是_______ 。
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是_______ (用离子符号表示)。
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:_______ 。
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
(6)由①、③、⑦组成的化合物中含有的化学键有_______ 。
(7)在含有①、④、⑤简单阳离子的 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
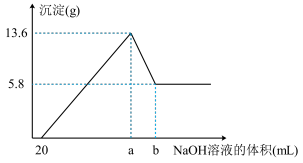
i.沉淀减少时发生的离子方程式:_______ 。
ii.a点的数值为_______  。
。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ④ | ⑤ | ⑧ | ⑨ | |||
| 4 | ③ | ⑩ | ||||||
(1)画出⑩的原子结构示意图:
(2)④和⑨两种元素形成的化合物的电子式是
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
A.②与 反应比④与 反应比④与 反应剧烈 反应剧烈 |
| B.②单质的熔、沸点比④的低 |
| C.②的最高价氧化物对应的水化物的碱性比④的最高价氧化物对应的水化物的碱性强 |
| D.与非金属单质反应时,②原子失电子数目比④原子失电子数目少 |
(7)在含有①、④、⑤简单阳离子的
 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
i.沉淀减少时发生的离子方程式:
ii.a点的数值为
 。
。
您最近一年使用:0次
名校
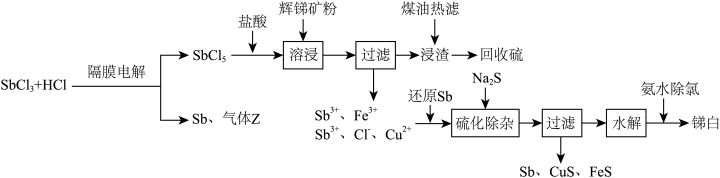
5 . 三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
及少量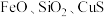 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,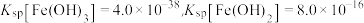 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量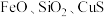 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
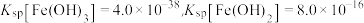 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
2023-02-03更新
|
419次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高三下学期开学摸底考试化学试题
名校
6 . X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法一定正确 的是
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.非金属性:X>Z>Y | D.原子序数:X>Y>Z |
您最近一年使用:0次
名校
解题方法
7 .  、
、 均为短周期元素,且
均为短周期元素,且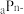 比
比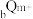 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )
 、
、 均为短周期元素,且
均为短周期元素,且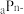 比
比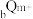 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )A. 可能是第一周期元素 可能是第一周期元素 | B. 和 和 —定位于相邻的两个周期 —定位于相邻的两个周期 |
C. 一定比 一定比 小 小 | D.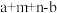 的值一定为8 的值一定为8 |
您最近一年使用:0次
2020-09-06更新
|
977次组卷
|
3卷引用:江西省井冈山大学附属中学2021-2022学年高二上学期开学考试化学(理科)试题
江西省井冈山大学附属中学2021-2022学年高二上学期开学考试化学(理科)试题人教版(2019)高一必修第一册第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 易错疑难集训(一)(已下线)练习12 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
名校
8 . W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
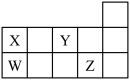

| A.四种元素中原子半径最大的为Z |
| B.四种元素最高价氧化物的水化物都是酸 |
| C.XZ4、WY2中所含化学键类型相同 |
| D.W、X形成的单质都是重要的半导体材料 |
您最近一年使用:0次
2019-06-29更新
|
737次组卷
|
5卷引用:河北省衡水市阜城中学2020-2021学年高二上学期开学考试化学试题
名校
9 . 下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A.原子序数W>Z>X>Y | B.纯净的X在Z2中燃烧生成XZ3 |
| C.Z的最高正价为+6 | D.HW是热稳定性最强的氢化物 |
您最近一年使用:0次
2019-06-29更新
|
455次组卷
|
2卷引用:湖南省长沙市明德中学2020-2021学年高一下学期开学考化学试卷
名校
10 . 下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
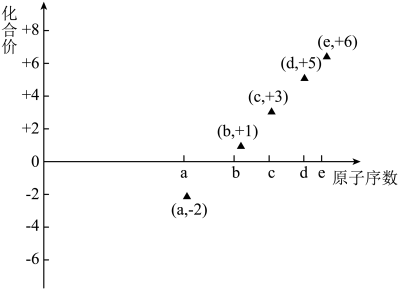

| A.31d和33d属于同种核素 |
| B.气态氢化物的稳定性:a>d>e |
| C.b、c的最高价氧化物对应水化物可以反应 |
| D.a和b形成的化合物不可能含共价键 |
您最近一年使用:0次
2019-06-26更新
|
1642次组卷
|
5卷引用:黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题



