名校
解题方法
1 . 下表为元素周期表的一部分,用请化学用语回答有关问题:
(1)C的元素符号是___________________ ;
(2)表中A与F的简单氢化物反应的化学方程式____________________________ ,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式_______________________________ ;
(3)表中所列元素中最高价氧化物对应水化物酸性最强的是__________________ (填写化学式)
(4)表中能形成的两性氢氧化物与A的最高价氧化物对应水化物反应的离子方程式____________________________________________________________ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)C的元素符号是
(2)表中A与F的简单氢化物反应的化学方程式
(3)表中所列元素中最高价氧化物对应水化物酸性最强的是
(4)表中能形成的两性氢氧化物与A的最高价氧化物对应水化物反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . I.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是_____________________ 。
(2)In的最高价氧化物的水化物的碱性______________ Ba(OH)2的碱性(填“>”或“<”)。
(3)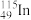 的中子数与电子数的差值为
的中子数与电子数的差值为_________________ 。
II.A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:_________________ 。
(5)A+、B2-、F3+离子半径由大到小的顺序为____________ (用离子符号表示)。
(6)电子式表示 A2B 的形成过程_______________________ 。
(7)含 F3+的溶液中通入过量D,反应的离子方程式是_______________ 。
(8)A 单质与 E 反应的离子方程式为_______________ ,生成的化合物中化学键的类型是____________________ 。
(1)In在周期表中的位置是
(2)In的最高价氧化物的水化物的碱性
(3)
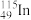 的中子数与电子数的差值为
的中子数与电子数的差值为II.A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:
(5)A+、B2-、F3+离子半径由大到小的顺序为
(6)电子式表示 A2B 的形成过程
(7)含 F3+的溶液中通入过量D,反应的离子方程式是
(8)A 单质与 E 反应的离子方程式为
您最近一年使用:0次
3 . 部分短周期元素的原子半径与元素的最高价及最低价的关系如图所示。
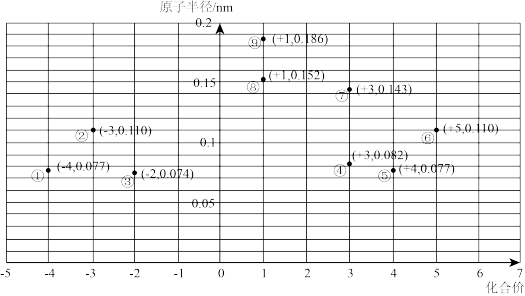
请填写下列空白:
(1)图中涉及________ 种元素,其中元素________ (用化学用语表示,下同 )的金属性最强。
(2)元素①的最简单氢化物的电子式为________ ;元素②的原子结构示意图为________ 。
(3)元素③和⑨对应的单质加热条件下反应的方程式为________________ 。
(4)元素④在周期表中的位置是________________ ;元素⑤、⑥对应的最高价氧化物的水化物酸性强弱关系为________ ;元素⑦和元素⑧两者核电荷数之差是________ 。

请填写下列空白:
(1)图中涉及
(2)元素①的最简单氢化物的电子式为
(3)元素③和⑨对应的单质加热条件下反应的方程式为
(4)元素④在周期表中的位置是
您最近一年使用:0次
名校
解题方法
4 . 下表是元素周期表的一部分,表中的每个字母表示一种元素,用化学用语回答下列问题:
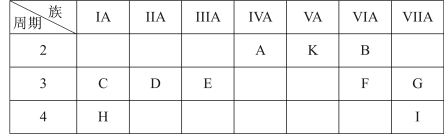
(1)写出上表中字母H对应的元素符号______ ,化合物CAK的电子式_______ 。
(2)E元素的最高价氧化物对应水化物与氢氧化钠反应的化学方程式是______ 。
(3)第ⅦA元素对应的简单氢化物的熔沸点较高的是_______ (填化学式),原因是___ 。
(4)C、D、H三种元素的原子半径由大到小顺序为______ 。
(5)F、G元素的最高价氧化物对应水化物的酸性较强的是___ (填化学式),A、B、F三种元素所形成的气态氢化物中稳定性较差的是_______ (填化学式)。
(6)联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似,联氨与硫酸形成的酸式盐的化学式为______ 。

(1)写出上表中字母H对应的元素符号
(2)E元素的最高价氧化物对应水化物与氢氧化钠反应的化学方程式是
(3)第ⅦA元素对应的简单氢化物的熔沸点较高的是
(4)C、D、H三种元素的原子半径由大到小顺序为
(5)F、G元素的最高价氧化物对应水化物的酸性较强的是
(6)联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似,联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
5 . 最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列,已知铯位于元素周期表中第六周期第IA族,根据艳在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有____ 个电子层,最外层电子数为___ .
(2)铯单质与水剧烈反应,放出______ 色气体,同时使紫色石蕊溶液显______ 色.
(3)预测铯单质的还原性比钠单质的还原性______ (填“弱”或“强”).
(1)铯的原子核外共有
(2)铯单质与水剧烈反应,放出
(3)预测铯单质的还原性比钠单质的还原性
您最近一年使用:0次
2020-09-09更新
|
323次组卷
|
2卷引用:【全国区级联考】湖南省娄底市娄星区2017-2018学年高一下学期期中考试理综(文)化学试题
名校
解题方法
6 . 下表是元素周期表的一部分,针对表中的①~⑩十种元素,填写下列空白:
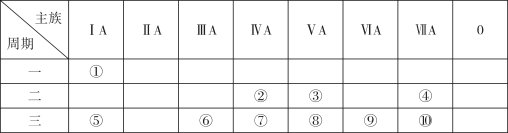
(1)形成化合物种类最多的元素的原子结构示意图为_____________ ,该元素有多种核素,其中一种考古时用于测定文物年代,请写出其原子符号____________ 。
(2)③⑤⑦三种元素的单质中,熔点最高的是____________ (写化学式),元素⑨的气态氢化物的电子式为____________ ,将⑩的单质通入该氢化物的水溶液中,发生反应的离子方程式为____________ 。
(3)这十种元素中,非金属性最强的元素为____________ (写元素符号);⑧⑨⑩三种元素的最高价氧化物对应的水化物中,酸性最弱的是____________ (写化学式)。
(4)⑤⑨⑩三种元素的简单离子半径,由大到小依次为____________ (写离子符号)。
(5)1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式____________ 。

(1)形成化合物种类最多的元素的原子结构示意图为
(2)③⑤⑦三种元素的单质中,熔点最高的是
(3)这十种元素中,非金属性最强的元素为
(4)⑤⑨⑩三种元素的简单离子半径,由大到小依次为
(5)1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
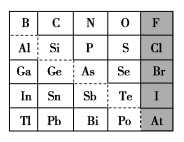
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1584次组卷
|
6卷引用:人教版(2019)高一必修第一册 全书综合训练(一)
8 . 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:

(1)元素⑩在周期表中的位置是______ ,⑦的原子结构示意图为______ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为____ (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是_____ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是____ (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式____________________________________ 。
(5)下列五种物质中,①H2O ②CO2 ③Na2O2 ④NaOH ⑤NaBr,
①只存在共价键的是______ ,只存在离子键的是_____ ,既存在离子键又存在共价键的是__ 。
②写出下列物质的电子式:CO2_________ ,NaOH___________ 。

(1)元素⑩在周期表中的位置是
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式
(5)下列五种物质中,①H2O ②CO2 ③Na2O2 ④NaOH ⑤NaBr,
①只存在共价键的是
②写出下列物质的电子式:CO2
您最近一年使用:0次
2020-09-08更新
|
691次组卷
|
2卷引用:新疆呼图壁县第一中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
9 . 如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是__ ;
(2)化学性质最不活泼的元素其原子的原子结构示意图为__ ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是__ ,碱性最强的是__ ,呈两性的氢氧化物是__ ;
(4)在③~⑦元素中,原子半径最大的是__ ;
(5)在⑦与⑩的单质中,化学性质较活泼的是____ ,可用什么化学反应说明该事实(写出反应的化学方程式):____ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是
(4)在③~⑦元素中,原子半径最大的是
(5)在⑦与⑩的单质中,化学性质较活泼的是
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分,其中甲~戊共五种元素,回答下列问题:
(1)五种元素最高价氧化物对应的水化物中酸性最强的是______ 填化学式,下同),显两性的是_____ 。
(2)乙与丙按原子数 1:1 形成的一种化合物,其电子式为_____ ,该化合物固态时所属晶体类型为_____ ,所含化学键类型有_________ 。
(3)乙、丙、丁三种元素分别形成简单离子,按离子半径从大到小的顺序排列为_____ (用离子符号表示)。
(4)有人认为,元素甲还可以排在第ⅦA族,理由是它们的负化合价都是_____ ;也有人认为,根据元素甲的正、负化合价代数和为零,也可以将元素甲排在第_________ 族。
(5)甲与丙两种元素形成的化合物与水反应,生成—种可燃性气体单质,该反应的化学方程式为_____ 。
(6)通常状况下,1g甲的单质在戊的单质中燃烧放热92kJ,写出该反应的热化学方程式_____
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | 甲 | ||||||
| 2 | 乙 | ||||||
| 3 | 丙 | 丁 | 戊 |
(1)五种元素最高价氧化物对应的水化物中酸性最强的是
(2)乙与丙按原子数 1:1 形成的一种化合物,其电子式为
(3)乙、丙、丁三种元素分别形成简单离子,按离子半径从大到小的顺序排列为
(4)有人认为,元素甲还可以排在第ⅦA族,理由是它们的负化合价都是
(5)甲与丙两种元素形成的化合物与水反应,生成—种可燃性气体单质,该反应的化学方程式为
(6)通常状况下,1g甲的单质在戊的单质中燃烧放热92kJ,写出该反应的热化学方程式
您最近一年使用:0次



