名校
1 . C、O、Na、Al、Si、S、Cl是生活中常见的几种元素。请回答下列问题:
(1)铝在元素周期表中的位置为______ 。
(2)在C、O、Si、S、Cl元素形成的简单氢化物中,稳定性最差的氢化物的电子式为______ 。
(3)利用图装置可验证同主族元素非金属性的变化规律:

①仪器A的名称为______ ,仪器D的作用为_______ 。
②若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成Cl2),C中加淀粉KI溶液,观察到C中溶液______ 的现象,即可证明,反应的离子方程式为______ 。
(1)铝在元素周期表中的位置为
(2)在C、O、Si、S、Cl元素形成的简单氢化物中,稳定性最差的氢化物的电子式为
(3)利用图装置可验证同主族元素非金属性的变化规律:

①仪器A的名称为
②若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成Cl2),C中加淀粉KI溶液,观察到C中溶液
您最近一年使用:0次
解题方法
2 . 下表列出了 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:

(1)f的名称是_______ ,d的元素符号是_______ ;
(2)a在周期表中的位置是_______ ;
(3)h的原子结构示意图是_______ ;
(4)e、g、i按原子半径由大到小的顺序排列为_______ (填元素符号);
(5)c与h相比非金属性较强的是_______ (填元素符号),h的氢化物与i的氢化物相比,稳定性较弱的是_______ (填化学式);
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为_______ ;
(7)g的单质与氧化铁在高温条件下反应的化学方程式为_______ ;
(8)i的氢化物的电子式为_______ 。
 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:
(1)f的名称是
(2)a在周期表中的位置是
(3)h的原子结构示意图是
(4)e、g、i按原子半径由大到小的顺序排列为
(5)c与h相比非金属性较强的是
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为
(7)g的单质与氧化铁在高温条件下反应的化学方程式为
(8)i的氢化物的电子式为
您最近一年使用:0次
名校
解题方法
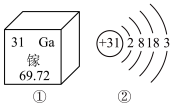
3 . 2019年是元素周期表年,镓是门捷列夫曾经预言的金属(类铝)。下图①是镓元素在元素周期表中的部分信息,②是镓原子的结构示意图。请回答:
A.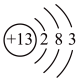 B.
B. 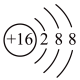 C.
C.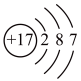 D.
D.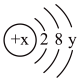
(1)镓原子的核电荷数为_______ ,镓元素的相对原子质量为_______ 。自然界中的镓共有两种稳定的同位素,其中69Ga的丰度为64.0%,则另一种镓的同位素质量数为_______ 。
(2)A、B、C三种微粒所属元素与镓元素化学性质相似的是_______ (填元素符号);微粒B的电子式为_______ ,则镓离子与B形成的化合物为_______ (填化学式)。
(3)D为某微粒的结构示意图,已知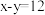 ,则x=
,则x=_______ ;写出C和D组成的化合物在水溶液中的电离方程式:_______ 。
(4)氮化镓(GaN)是第三代半导体材料,一般采用 与
与 在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为_______ 。

A.
 B.
B.  C.
C. D.
D.
(1)镓原子的核电荷数为
(2)A、B、C三种微粒所属元素与镓元素化学性质相似的是
(3)D为某微粒的结构示意图,已知
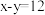 ,则x=
,则x=(4)氮化镓(GaN)是第三代半导体材料,一般采用
 与
与 在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
您最近一年使用:0次
解题方法
4 . NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)H元素位于元素周期表的第____ 周期第IA族。
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的____ (填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是___ (填“H”或“O”)。
(4)Na的最高价氧化物的化学式为____ 。
(1)H元素位于元素周期表的第
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的
(3)NaOH所含的两种非金属元素中,非金属性较强的是
(4)Na的最高价氧化物的化学式为
您最近一年使用:0次
名校
解题方法
5 . 为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表的一部分,数字①~⑦代表前四周期七种主族元素。请按题目要求回答下列问题:
(1)①~⑦对应元素中,非金属性最强的元素名称是_______ ;⑤在周期表中的位置为_______ 。
(2)②与③形成化合物的电子式为_______ ;①的最高价氧化物的结构式为_______ 。
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是_______ (用化学式来回答)。
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是_______ (填对应的序号)。
| ① | ② | |||||||
| ③ | ④ | ⑤ | ||||||
| ⑥ | …… | ⑦ | ||||||
(2)②与③形成化合物的电子式为
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是
您最近一年使用:0次
2022-09-08更新
|
114次组卷
|
2卷引用:辽宁省锦州市2019-2020学年高一上学期期末考试化学试题
名校
6 . 下表是元素周期表的一部分,请依据该表回答问题。
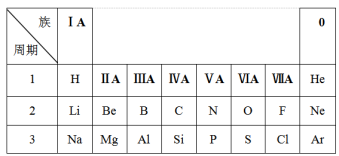
(1)第2周期VIIA族元素的原子结构示意图是___________ ,该元素与同周期IA族元素组成的化合物类型是___________ (填“离子化合物”或“共价化合物”)。
(2)第3周期元素的最高价氧化物对应水化物中,碱性最强的是___________ (填化学式,下同);具有两性的是___________ 。加热时,碳单质能与S的最高价氧化物对应的水化物的浓溶液反应,写出该反应的化学方程式___________ 。
(3)下列判断正确的是___________(填标号)。

(1)第2周期VIIA族元素的原子结构示意图是
(2)第3周期元素的最高价氧化物对应水化物中,碱性最强的是
(3)下列判断正确的是___________(填标号)。
| A.最低负化合价的绝对值:P>S |
| B.非金属性:P>N |
| C.离子半径:Mg2+>O2− |
| D.还原性:S2−>Cl− |
您最近一年使用:0次
7 . 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示。
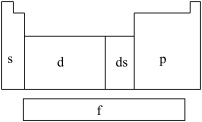
(1)在s区中,族序数最大、原子序数最小的元素原子的价电子的电子云形状为___________ 。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为___________ ,其中较稳定的是___________ 。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为___________ 。
(4)在p区中,第二周期ⅤA族元素原子的价电子排布图为___________ 。
(5)当今常用于核能开发的元素是铀和钚,它们在___________ 区中。

(1)在s区中,族序数最大、原子序数最小的元素原子的价电子的电子云形状为
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为
(4)在p区中,第二周期ⅤA族元素原子的价电子排布图为
(5)当今常用于核能开发的元素是铀和钚,它们在
您最近一年使用:0次
2021-12-04更新
|
554次组卷
|
9卷引用:同步君 选修3 第一章 第二节 原子结构与元素周期表
(已下线)同步君 选修3 第一章 第二节 原子结构与元素周期表高中化学人教版 选修三 第1章 原子结构与性质 原子结构与元素周期表山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(已下线)第30讲 原子结构与性质(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)1.2.1 原子结构与元素周期表(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.1 原子结构与元素周期表-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性2.2.1原子核外电子排布的周期性 课后
名校
解题方法
8 . 下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
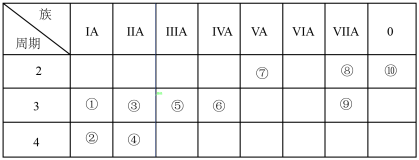
(1)③的原子结构示意图是___________ 。
(2)①~⑨中非金属性最强的元素是___________ (填化学式)。
(3)①和⑨两种元素组成的化合物中含有的化学键是___________ (填“共价键”或“离子键”)。
(4)①、⑤的最高价氧化物对应的水化物相互反应的离子方程式为___________ 。

(1)③的原子结构示意图是
(2)①~⑨中非金属性最强的元素是
(3)①和⑨两种元素组成的化合物中含有的化学键是
(4)①、⑤的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
名校
9 . 已知A、B两种元素,A的原子序数为x,A和B所在周期的元素种类数目分别为m和n。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为___________ ,当B在A的下一周期时,B的原子序数为___________ ;
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________ ;当B在A的下一周期时,B的原子序数为___________ 。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为
您最近一年使用:0次
2021-09-02更新
|
658次组卷
|
4卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题
云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题(已下线)4.1.2 元素周期表 核素-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)5.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题B卷
10 . 如图是元素周期表的另一种画法一塔式周期表,在上面标有部分族及部分元素。请回答下列问题:
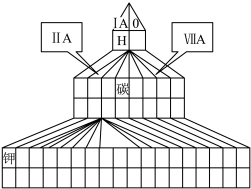
(1)请在图上把过渡元素涂黑。___________
(2)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。
①在如图塔式周期表相应位置标出A、B、C、D四种元素的元素符号。___________
②写出上述元素组成的具有漂白作用的四种物质的化学式:___________ 、___________ 、___________ 、___________ 。
③C与D形成D的最低价化合物的电子式:___________ 。
④仅由B、C、D三种元素组成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因___________ 。
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2、8、8、18、18,可分为三类。第四类元素有两行,其中每行所包含的元素均为___________ 种。请根据行数与元素种数的关系,预言第八行最多可能含有___________ 种元素。

(1)请在图上把过渡元素涂黑。
(2)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。
①在如图塔式周期表相应位置标出A、B、C、D四种元素的元素符号。
②写出上述元素组成的具有漂白作用的四种物质的化学式:
③C与D形成D的最低价化合物的电子式:
④仅由B、C、D三种元素组成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2、8、8、18、18,可分为三类。第四类元素有两行,其中每行所包含的元素均为
您最近一年使用:0次



