1 . 下列装置(部分夹持装置略去)中仪器使用规范且能达到实验目的的是
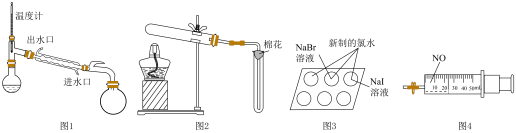
| A.图1:采用蒸馏法分离正己烷(沸点69℃)和正庚烷(沸点98℃) |
B.图2:用 和 和 制备并收集 制备并收集 |
| C.图3:通过观察实验现象,验证氯、溴和碘元素性质的递变规律 |
D.图4:利用该装置实现NO、 和 和 充分反应转化为 充分反应转化为 |
您最近一年使用:0次
2024-05-14更新
|
89次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
解题方法
2 . 某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成分,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________ 。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___ ,反应的离子方程式为_____ 。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___ (填“正确”或“不正确”),理由是(用离子方程式表示)______________________ 。
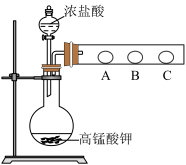
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______ 。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________ 。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______ (填“能”或“不能”),理由是______________ 。

(1)甲同学想探究“铝热反应”中熔融物的成分,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有

(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的

您最近一年使用:0次
解题方法
3 . 用下列装置进行实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 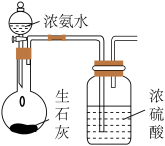 | 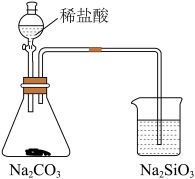 | 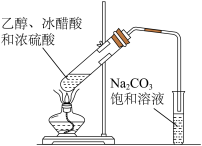 | 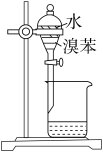 |
| 目的 | 制备干燥的氨气 | 证明非金属性 Cl>C>Si | 制备乙酸乙酯 | 分离出溴苯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 化学是以实验为基础的科学。下列实验设计正确的是
| 选项 | 实验目的 | 实验设计 |
| A | 除去乙酸乙酯中的乙酸 | 加入NaOH溶液,振荡后分液 |
| B | 验证非金属性:O>S | 向 溶液中通入 溶液中通入 ,观察溶液变浑浊 ,观察溶液变浑浊 |
| C | 由 溶液制备无水 溶液制备无水 | 将 溶液加热蒸干 溶液加热蒸干 |
| D | 配制100mL一定物质的量浓度的NaOH溶液 | 准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
| 选项 | A | B | C | D |
| 装置图 |  |  |  |  |
| 现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
| 结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3和SO2 | 非金属性:C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-02-24更新
|
391次组卷
|
4卷引用:四川省遂宁市第二中学2020届高三上学期第二次高考模拟理综化学试题
6 . 四氯化锡是重要的化工中间体和催化剂。常温下。四氯化锡为无色液体,易溶于四氯化碳、苯等有机溶剂,极易与水反应生成锡酸(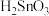 ,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分
,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分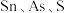 等)制备少量四氯化锡,装置如图所示。
等)制备少量四氯化锡,装置如图所示。
实验步骤:
①连接装置并检险装置气密性。
②连接 装置并加入相应试剂后,通入氮气。
装置并加入相应试剂后,通入氮气。
③控制仪器a的活塞缓慢加入浓盐酸并加热。将产生的气体缓慢通入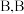 中温度维持在
中温度维持在 ,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
回答下列问题:
(1)仪器a的名称为_____ 。仪器b中的试剂为_____ 。
(2)步骤②通入氮气的作用是_____ 。
(3)步骤③开始缓慢通入氯气,当出现较多液态物质时,可适当加快通入氯气的原因是_____ 。装置B中的温度需特维持在 ,若温度高于
,若温度高于 ,可能造成的后果是
,可能造成的后果是_____ ,应采取的措施是_____ 。
(4)四氯化锡与足量氢氧化钠溶液剧烈反应,所发生反应的化学方程式为_____ 。
(5)上述制得的四氯化锡液体中可能存在的液态杂质为_____ 。该杂质能使酸性高锰酸钾溶液褪色,生成一种对应的最高价含氧酸,该反应的离子方程式为_____
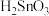 ,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分
,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分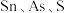 等)制备少量四氯化锡,装置如图所示。
等)制备少量四氯化锡,装置如图所示。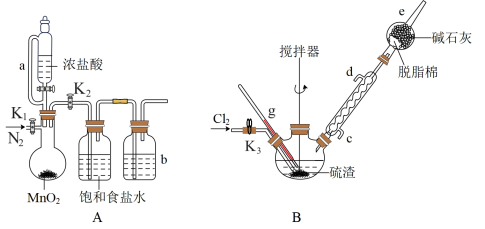
| 物质 |  |  | S |
熔点 |  |  | 112 |
沸点 | 114 | 130 | 444 |
①连接装置并检险装置气密性。
②连接
 装置并加入相应试剂后,通入氮气。
装置并加入相应试剂后,通入氮气。③控制仪器a的活塞缓慢加入浓盐酸并加热。将产生的气体缓慢通入
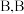 中温度维持在
中温度维持在 ,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。回答下列问题:
(1)仪器a的名称为
(2)步骤②通入氮气的作用是
(3)步骤③开始缓慢通入氯气,当出现较多液态物质时,可适当加快通入氯气的原因是
 ,若温度高于
,若温度高于 ,可能造成的后果是
,可能造成的后果是(4)四氯化锡与足量氢氧化钠溶液剧烈反应,所发生反应的化学方程式为
(5)上述制得的四氯化锡液体中可能存在的液态杂质为
您最近一年使用:0次
2011·陕西西安·模拟预测
7 . 为了验证碱金属元素和第三周期金属元素金属性的相对强弱,某课外活动小组的同学设计如下实验,请根据要求回答下列问题:
(1)取少量金属钠和金属钾分别放入盛_______ 的烧杯中,观察到钾的现象是_______ ;由此得出的结论是_______ 。
(2)将镁条打磨至银白色后放入盛有上述物质的试管中,_______ 明显现象(填“有”或“没有”),_______ 后(填操作名称)可观察到有大量气泡产生,反应的化学方程式是_______ ;
(3)将打磨好的镁条和铝条分别放入盛_______ 的试管中,观察到明显的现象,铝条反应的离子方程式是_______ ,由(1)(2)(3)可得出的结论是_______ ;
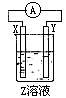
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是_______ ,其负极的电极反应式是_______
(1)取少量金属钠和金属钾分别放入盛
(2)将镁条打磨至银白色后放入盛有上述物质的试管中,
(3)将打磨好的镁条和铝条分别放入盛
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是

您最近一年使用:0次



