1 . 某研究性学习小组设计了一组实验验证元素周期律。
I.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐_______ 。
(2)烧杯中反应最剧烈的金属是_______(填字母)。
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______(填字母)。
II.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。
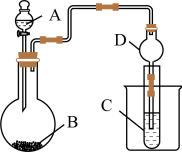
(4)实验装置:
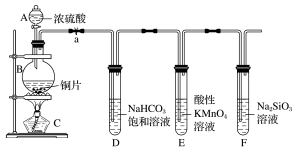
仪器B的名称为_______ 。
(5)实验步骤:连接仪器、_______ 、加药品,打开a,然后滴入浓硫酸,加热。
(6)问题探究:(已知酸性亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是_______ ;装置E中酸性KMnO4溶液的作用是_______ 。
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_______ ;试管F中发生反应的离子方程式为_______ 。
③依据试管D中的反应,能否证明S的非金属性强于C的非金属性?_______ (填“能”或“否”)。说明理由_______ 。
I.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐
(2)烧杯中反应最剧烈的金属是_______(填字母)。
| A.钠 | B.镁 | C.铝 | D.钾 |
| A.把镁、铝的金属块换成金属粉末 | B.把烧杯中的冷水换成热水 |
| C.把烧杯中的冷水换成等量的同浓度的盐酸 | D.把烧杯中的冷水换成氢氧化钠溶液 |
II.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。
(4)实验装置:

仪器B的名称为
(5)实验步骤:连接仪器、
(6)问题探究:(已知酸性亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
③依据试管D中的反应,能否证明S的非金属性强于C的非金属性?
您最近一年使用:0次
名校
解题方法
2 . 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______ (填字母序号);
A.钠 B.镁 C.铝 D.钾
(2)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______ (填字母序号)。
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)

(3)铜与浓硫酸反应的化学方程式是_______ ;
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_______ ;试管F中发生反应的离子方程式为_______ 。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是
A.钠 B.镁 C.铝 D.钾
(2)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)

(3)铜与浓硫酸反应的化学方程式是
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是
您最近一年使用:0次
2021-04-29更新
|
200次组卷
|
2卷引用:山东省济南外国语学校2022-2023学年高一3月月考化学试题
3 . 用如图装置能达到相应实验目的是
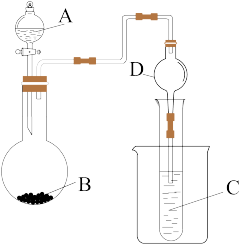

| 选项 | 试剂A | 试剂B | 试剂C | 实验目的 |
| A | 稀盐酸 | NaHCO3 | 澄清石灰水 | 验证得电子能力Cl>C |
| B | 浓氨水 | 生石灰 | 酚酞 | 验证NH3·H2O是弱碱 |
| C | 氯水 | 淀粉KI溶液 | NaOH溶液 | 证明氧化性Cl2>I2 |
| D | 稀硝酸 | CaCO3 | Na2SiO3溶液 | 验证得电子能力N>C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学设计了如图的装置来一次性完成元素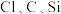 非金属性强弱比较的实验研究。
非金属性强弱比较的实验研究。
可选用的实验药品有:1.0mol/LHCl(挥发性强酸)、1.0mol/LHClO4(挥发性强酸)、碳酸钙(固体)、1.0mol/L水玻璃。打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
(1)图一中A的仪器名称为___________ ,所装的试剂为___________ (只填化学式)。

(2)B中发生反应的离子方程式为___________ 。
(3)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,洗气瓶中盛装的液体为___________
Ⅱ.丙同学设计了如图的装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(4)A处反应的离子方程式:___________ ,B处的实验现象为___________ ,C处沾有NaOH溶液的棉花的作用为___________ 。
(5)该实验___________ 验证非金属性Cl>Br>I(填“能”或“不能”)
Ⅰ.甲同学设计了如图的装置来一次性完成元素
 非金属性强弱比较的实验研究。
非金属性强弱比较的实验研究。可选用的实验药品有:1.0mol/LHCl(挥发性强酸)、1.0mol/LHClO4(挥发性强酸)、碳酸钙(固体)、1.0mol/L水玻璃。打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
(1)图一中A的仪器名称为

(2)B中发生反应的离子方程式为
(3)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,洗气瓶中盛装的液体为
Ⅱ.丙同学设计了如图的装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(4)A处反应的离子方程式:
(5)该实验
您最近一年使用:0次
解题方法
5 . Ⅰ.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的3倍,Y和Z可以形成两种以上气态化合物。则:
(1)X是__________ (填元素名称,下同),Y是__________ ,Z是__________ 。
(2)画出Z的离子结构示意图__________ 。
(3)由Y和Z组成,且Y和Z质量比为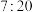 的化合物的化学式是
的化合物的化学式是__________ 。
(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为__________ ,四核10电子的分子的化学式是_______ 。
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为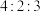 ,该盐的化学式是
,该盐的化学式是_____ 。
Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。
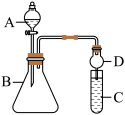
(6)仪器A的名称为__________ ,干燥管D的作用为__________ 。
(7)若要证明非金属性: ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为__________ ,观察到C中溶液__________ (填现象),即可证明非金属性: 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用__________ 吸收尾气。
(1)X是
(2)画出Z的离子结构示意图
(3)由Y和Z组成,且Y和Z质量比为
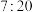 的化合物的化学式是
的化合物的化学式是(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为
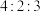 ,该盐的化学式是
,该盐的化学式是Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。

(6)仪器A的名称为
(7)若要证明非金属性:
 ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
您最近一年使用:0次
2023-03-24更新
|
105次组卷
|
2卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
6 . 为研究同主族元素性质的递变规律,某小组以第VIIA元素为例用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

已知: 的氧化性大于
的氧化性大于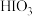
(1)仪器X的名称为___________ ,A中反应的离子方程式___________ 。
(2)探究卤素单质氧化性的相对强弱,将实验现象填写在下表对应的空格里:
(3)操作步骤III的实验目的是___________ 。
(4)结合元素周期律解释氯、溴、碘单质的氧化性逐渐减小的原因:___________ 。
(5)实验中若氯气的通入量过多,淀粉碘化钾试纸会逐渐褪色,可能的原因____ 。

已知:
 的氧化性大于
的氧化性大于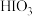
(1)仪器X的名称为
(2)探究卤素单质氧化性的相对强弱,将实验现象填写在下表对应的空格里:
| 操作步骤 | 实验现象 |
| I.打开弹簧夹、活塞a,滴加浓盐酸。 II.当B和C中分液漏斗中的溶液都变为黄色时,夹紧弹簀夹。 | 湿润的淀粉碘化钾试纸 |
| III.当B中溶液由黄色变为棕色时,关闭活塞a。 IV.打开活塞b,将少量溶液滴入C中,关闭活塞b,取下C振荡。 | 试管C中的现象为 |
(4)结合元素周期律解释氯、溴、碘单质的氧化性逐渐减小的原因:
(5)实验中若氯气的通入量过多,淀粉碘化钾试纸会逐渐褪色,可能的原因
您最近一年使用:0次
2022-05-10更新
|
380次组卷
|
4卷引用:山东省潍坊第四中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
7 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:(用元素符号或化学式回答下列问题)
___________ 与盐酸反应最剧烈,___________ 与盐酸反应的速度最慢;___________ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
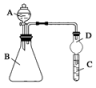
(1)仪器A的名称为___________ ,干燥管D的作用为___________ 。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液___________ 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用___________ 溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液___________ 的现象即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有___________ 溶液的洗气瓶除去。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:(用元素符号或化学式回答下列问题)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液
您最近一年使用:0次
2021-04-02更新
|
233次组卷
|
3卷引用:福建省建瓯市芝华中学2022-2023学年高一下学期第一次月考化学试题
8 . 某校化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol/L的盐酸中,试预测实验结果:________ 与盐酸反应最剧烈,________ 与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的碱性,继而可以验证Na的金属性强于N的金属性,你认为此设计是否合理,并说明理由_______ 。
Ⅱ.利用如所示装置可以验证元素的非金属性的变化规律。______ ,D的作用是__________ 。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为_________ 、_________ 、_________ ,装置C中的实验现象为有淡黄色沉淀生成,则反应的离子方程式为___________ 。
(5)若要证明非金属性C>Si,则A中应加入________ 溶液,B中应加入Na2CO3,C中应加入______ 溶液,装置C中的现象为________ 。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol/L的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的碱性,继而可以验证Na的金属性强于N的金属性,你认为此设计是否合理,并说明理由
Ⅱ.利用如所示装置可以验证元素的非金属性的变化规律。
已知:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为
(5)若要证明非金属性C>Si,则A中应加入
您最近一年使用:0次
2020-09-24更新
|
685次组卷
|
3卷引用:福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题
解题方法
9 . 1875年,法国化学家布瓦博德朗发现了门捷列夫预言的“类铝”,即新元素镓。金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。某学校化学兴趣小组在实验室利用如图装置模拟制备三氯化镓,并用该装置验证卤素单质氧化性的相对强弱。
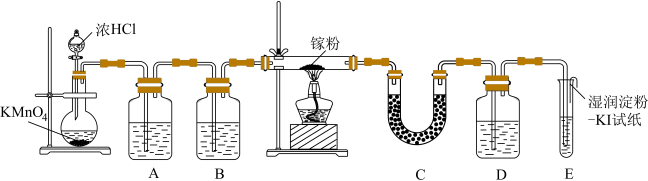
已知:①三氯化镓( )具有很强的吸湿性,在空气中吸收湿气而冒烟。
)具有很强的吸湿性,在空气中吸收湿气而冒烟。
②在氯气流中加热镓可制备 ,反应方程式
,反应方程式 。
。
(1)写出
 与浓盐酸反应制取氯气的离子方程式:
与浓盐酸反应制取氯气的离子方程式:(2)装置B中的试剂为
(3)D中装有NaBr溶液,反应开始后能通过D证明卤素单质氧化性相对强弱的现象是
(4)请推测写
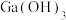 与NaOH反应的化学方程式
与NaOH反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器和加热装置已略去,气密性已检验)。

实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中利用浓盐酸和MnO2固体的反应制备氯气,反应的离子方程式是______ 。
(2)验证氯气的氧化性强于碘的实验现象是______ 。
(3)B中溶液发生反应的离子方程式是______ 。
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,_____ 。
(5)过程III实验的目的是_____ 。
(6)从原子结构角度分析氯、溴、碘单质的氧化性逐渐减弱的原因:_____ 。

实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中利用浓盐酸和MnO2固体的反应制备氯气,反应的离子方程式是
(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,
(5)过程III实验的目的是
(6)从原子结构角度分析氯、溴、碘单质的氧化性逐渐减弱的原因:
您最近一年使用:0次
2023-01-17更新
|
731次组卷
|
3卷引用:山东省东明县第一中学2022-2023学年高一下学期3月月考化学试题



