名校
解题方法
1 . 回答下列问题:
(1)②元素原子的电子式是:_______ 。
(2)硅元素在周期表中的位置是:第_______ 周期_______ 族。
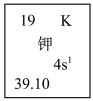
(3)如图所示钾元素的部分信息,“30.97”数值表示_______ 。______ (填元素符号)。③和⑧两种元素形成的气态氢化物稳定性强的是_______ (填化学式)。写出④的最高价氧化物对应水合物和⑧的最高价氧化物对应水合物相互反应的化学方程式_______ 。
(5)Cl元素比S元素的非金属性强,请从原子结构角度解释原因_______ 。能证明这一事实的化学反应为_______ (写一个化学方程式)。
(6)能证明O元素的非金属性强于S元素的依据是_______ 。
A.热稳定性:H2O>H2S B.SO2中O显负价 C.沸点:S>O2
(7)氧元素有三种核素:16O、17O、18O,对这三种核素的描述错误的是_______ 。
(8)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是_______ 。
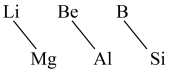
(9)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。下列叙述错误的是_______ 。
族 周期 | ⅠA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)②元素原子的电子式是:
(2)硅元素在周期表中的位置是:第
(3)如图所示钾元素的部分信息,“30.97”数值表示
(5)Cl元素比S元素的非金属性强,请从原子结构角度解释原因
(6)能证明O元素的非金属性强于S元素的依据是
A.热稳定性:H2O>H2S B.SO2中O显负价 C.沸点:S>O2
(7)氧元素有三种核素:16O、17O、18O,对这三种核素的描述错误的是
| A.质子数相同 | B.质量相同 |
| C.化学性质相同 | D.位置相同(周期表中) |
(8)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是
| A.在周期表中金属与非金属的分界处可以找到催化剂材料 |
| B.对氟、氯、硫、磷、砷等元素的研究,有助于制造出新品种的农药 |
| C.在过渡元素中可寻找制造半导体的元素 |
| D.可在第IA、IIA族元素中寻找制造耐高温、耐腐蚀合金的元素 |
(9)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。下列叙述错误的是
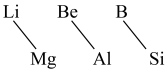
| A.Li在空气中燃烧生成Li2O、Li3N | B.硼酸是弱酸 |
| C.Be不与水反应 | D.Be(OH)2是两性氢氧化物 |
您最近半年使用:0次
名校
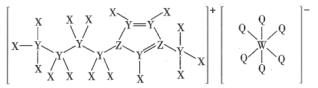
2 . 离子液体在电化学领域用途广泛,某离子液体的结构如图所示。 、
、 、
、 、
、 、
、 为原子序数依次增大的五种短周期主族元素,
为原子序数依次增大的五种短周期主族元素, 原子中电子只有一种自旋方向,
原子中电子只有一种自旋方向, 、
、 、
、 为同一周期元素,
为同一周期元素, 与
与 同主族,
同主族, 的原子核外有3个未成对电子。下列说法正确的是
的原子核外有3个未成对电子。下列说法正确的是
 、
、 、
、 、
、 、
、 为原子序数依次增大的五种短周期主族元素,
为原子序数依次增大的五种短周期主族元素, 原子中电子只有一种自旋方向,
原子中电子只有一种自旋方向, 、
、 、
、 为同一周期元素,
为同一周期元素, 与
与 同主族,
同主族, 的原子核外有3个未成对电子。下列说法正确的是
的原子核外有3个未成对电子。下列说法正确的是
A. 是平面形分子 是平面形分子 |
B.简单离子半径: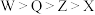 |
C. 、 、 、 、 的最高价氧化物对应的水化物的酸性: 的最高价氧化物对应的水化物的酸性: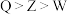 |
D.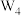 分子中 分子中 的杂化轨道类型是 的杂化轨道类型是 杂化 杂化 |
您最近半年使用:0次
2024-03-06更新
|
321次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期月考(七)理综化学试题
名校
3 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近半年使用:0次
解题方法
4 . 锂的用途很广泛,涉及电池、核工业等领域。下列说法错误的是
| A.钠与水的反应比锂更剧烈 |
| B.锂是最轻的金属,具有银白色光泽 |
| C.锂在氧气中燃烧的产物主要是氧化锂 |
| D.等质量的锂和钾相比,钾与水反应生成的H2较多 |
您最近半年使用:0次
5 . X、Y、Z、M、Q为前四周期元素,原子序数依次增大。X的族序数等于其周期数,Y和M同族,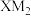 分子和
分子和 分子中X、Z均显最高价。Q是用途最广、用量最大的金属。下列说法正确的是
分子中X、Z均显最高价。Q是用途最广、用量最大的金属。下列说法正确的是
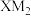 分子和
分子和 分子中X、Z均显最高价。Q是用途最广、用量最大的金属。下列说法正确的是
分子中X、Z均显最高价。Q是用途最广、用量最大的金属。下列说法正确的是A.一个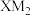 分子含1个 分子含1个 和2个 和2个 | B.X的氢氧化物能与NaOH溶液反应 |
| C.Y的气态氢化物沸点比M的气态氢化物低 | D.基态Q原子的价电子排布式为 |
您最近半年使用:0次
名校
6 . 元素周期表是研究化学的重要工具。下表为元素周期表的一部分,请根据元素①~⑧所处的位置回答下列问题。

(1)元素④⑤⑧的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)元素⑦的原子结构示意图为_______ ;元素④⑦的最简单氢化物的稳定性关系为_______ (用化学式表示)。
(3)由元素④⑤组成原子个数比为1:1的化合物中含_______ (填“离子键”、“共价键” 或“离子键和共价键”);将78g该化合物投入98g水中,所得溶液的质量分数为_______ 。
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是_______ (填化学式);该酸与元素⑥的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(5)由元素①③组成的含10e-和18e-的分子的电子式分别是_______ 、_______ 。
(6)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是
(7)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。下列叙述错误的是

(1)元素④⑤⑧的离子半径由大到小的顺序为
(2)元素⑦的原子结构示意图为
(3)由元素④⑤组成原子个数比为1:1的化合物中含
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是
(5)由元素①③组成的含10e-和18e-的分子的电子式分别是
(6)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是
| A.在周期表中金属与非金属的分界处可以找到催化剂材料 |
| B.对氟、氯、硫、磷、砷等元素的研究,有助于制造出新品种的农药 |
| C.在过渡元素中可寻找制造半导体的元素 |
| D.可在第ⅠA、ⅡA族元素中寻找制造耐高温、耐腐蚀合金的元素 |

| A.Li在空气中燃烧生成Li2O、Li3N | B.硼酸是弱酸 |
| C.BeCl2是离子化合物 | D.Be(OH)2是两性氢氧化物 |
您最近半年使用:0次
解题方法
7 . 针对下面10种元素,完成以下各小题。
(1)地壳中含量最多的元素是_______ (填名称)。
(2)化学性质最不活泼的元素是_______ (填元素符号)。
(3)Al的原子结构示意图为_______ 。
(4)C与N相比,原子半径较小的是_______ 。
(5)最高价氧化物对应的水化物碱性最强的是_______ (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是_______ 。
(7)S和Cl相比,元素非金属性较强的是_______ 。
(8)可用来制造光导纤维的物质是_______ ,晶体硅的主要用途是_______ (写出一种)。
(9)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:_______ 。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(1)地壳中含量最多的元素是
(2)化学性质最不活泼的元素是
(3)Al的原子结构示意图为
(4)C与N相比,原子半径较小的是
(5)最高价氧化物对应的水化物碱性最强的是
(6)MgO和Al2O3中,属于两性氧化物的是
(7)S和Cl相比,元素非金属性较强的是
(8)可用来制造光导纤维的物质是
(9)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:
您最近半年使用:0次
解题方法
8 . 下表是元素周期表的一部分,根据表中给出10种元素,按要求作答。
(1)光导纤维的主要成分是_______ (填化学式)。
(2)形成化合物种类最多的元素_______ (填元素符号)。
(3)③、⑧、⑨的氢化物稳定性最强的是_______ (填化学式)。
(4)元素④、⑥的最高价氧化物对应的水化物之间可以相互反应,写出该反应的离子方程式___ 。
(5)元素②和⑤形成的化合物中含有_______ (填“离子键”或“共价键”)
(6)画出⑩的原子结构示意图_______ 。
(7)高温下,⑥单质与氧化铁反应的化学方程式为_______ ,该反应可用于_______ (填用途)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)形成化合物种类最多的元素
(3)③、⑧、⑨的氢化物稳定性最强的是
(4)元素④、⑥的最高价氧化物对应的水化物之间可以相互反应,写出该反应的离子方程式
(5)元素②和⑤形成的化合物中含有
(6)画出⑩的原子结构示意图
(7)高温下,⑥单质与氧化铁反应的化学方程式为
您最近半年使用:0次
2022-05-20更新
|
77次组卷
|
2卷引用:福建省三明市四地四校2021-2022学年高一下学期期中联考化学试题
名校
解题方法
9 . 四种短周期元素X、Y、Z、W在周期表中的位置如表所示,其中Z元素的最外层电子数是内层电子总数的 。试回答下列问题。
。试回答下列问题。
(1)Y元素在元素周期表中的位置___________ 。四种元素中原子半径最大的是___________ (填元素符号)。
(2)写出Y的氧化物的一种用途___________ 。
(3)能证明W的非金属性强于Y的事实是___________ 。
a.W的氢化物水溶液显酸性,Y的氢化物不显酸性
b.Y的氢化物不如W的氢化物稳定
c.简单阴离子的还原性:Y>W
(4)+2价X的氧化物可将W的+4价氧化物还原为W单质,恢复至室温时,生成1 mol W放热269.0 kJ,则该反应的热化学方程式为___________ 。
(5)W的最高价氧化物对应的水化物可以氧化Z的氢化物,并将Z氧化为最高价氧化物,写出反应的化学方程式___________ 。氧化1 mol Z的氢化物转移电子的物质的量为___________ 。
 。试回答下列问题。
。试回答下列问题。X | ||
Y | Z | W |
(1)Y元素在元素周期表中的位置
(2)写出Y的氧化物的一种用途
(3)能证明W的非金属性强于Y的事实是
a.W的氢化物水溶液显酸性,Y的氢化物不显酸性
b.Y的氢化物不如W的氢化物稳定
c.简单阴离子的还原性:Y>W
(4)+2价X的氧化物可将W的+4价氧化物还原为W单质,恢复至室温时,生成1 mol W放热269.0 kJ,则该反应的热化学方程式为
(5)W的最高价氧化物对应的水化物可以氧化Z的氢化物,并将Z氧化为最高价氧化物,写出反应的化学方程式
您最近半年使用:0次
2021-11-07更新
|
211次组卷
|
2卷引用:河南省六市重点高中2021-2022学年高三上学期11月联合考试化学试题
10 .  、
、 、
、 、
、 、
、 、
、 六种短周期主族元素,其原子序数依次增大。
六种短周期主族元素,其原子序数依次增大。 是形成化合物种类最多的元素,
是形成化合物种类最多的元素, 、
、 能形成两种液态化合物
能形成两种液态化合物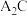 和
和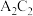 ,
, 、
、 同主族,
同主族, 元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ , 、
、 、
、 三种元素的原子半径由大到小顺序为
三种元素的原子半径由大到小顺序为___________ (用原子符号表示)。
(2)化合物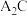 、
、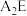 性质比较:热稳定性:
性质比较:热稳定性: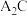
___ 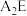 ;沸点:
;沸点: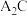
____ 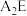 (填“
(填“ ”或“
”或“ ”)。
”)。
(3)物质 由
由 、
、 两种元素组成,
两种元素组成, 的产量可以用来衡量一个国家的石油化工发展水平,则
的产量可以用来衡量一个国家的石油化工发展水平,则 分子的电子式为:
分子的电子式为:___________ ,将 通入溴的四氧化碳溶液中,发生反应的化学方程式为
通入溴的四氧化碳溶液中,发生反应的化学方程式为___________ 。
(4) 的单质和化合物是一种用途很广的材料。写出
的单质和化合物是一种用途很广的材料。写出 单质与氧化铁高温加热制取铁的化学方程式:
单质与氧化铁高温加热制取铁的化学方程式:___________ 。
(5)向 溶液中通入适量的
溶液中通入适量的 单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:___________ 。
 、
、 、
、 、
、 、
、 、
、 六种短周期主族元素,其原子序数依次增大。
六种短周期主族元素,其原子序数依次增大。 是形成化合物种类最多的元素,
是形成化合物种类最多的元素, 、
、 能形成两种液态化合物
能形成两种液态化合物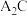 和
和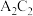 ,
, 、
、 同主族,
同主族, 元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
元素的周期序数与主族序数相等。根据以上信息,回答下列问题:(1)
 元素在周期表中的位置为
元素在周期表中的位置为 、
、 、
、 三种元素的原子半径由大到小顺序为
三种元素的原子半径由大到小顺序为(2)化合物
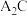 、
、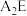 性质比较:热稳定性:
性质比较:热稳定性: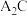
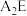 ;沸点:
;沸点: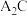
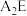 (填“
(填“ ”或“
”或“ ”)。
”)。(3)物质
 由
由 、
、 两种元素组成,
两种元素组成, 的产量可以用来衡量一个国家的石油化工发展水平,则
的产量可以用来衡量一个国家的石油化工发展水平,则 分子的电子式为:
分子的电子式为: 通入溴的四氧化碳溶液中,发生反应的化学方程式为
通入溴的四氧化碳溶液中,发生反应的化学方程式为(4)
 的单质和化合物是一种用途很广的材料。写出
的单质和化合物是一种用途很广的材料。写出 单质与氧化铁高温加热制取铁的化学方程式:
单质与氧化铁高温加热制取铁的化学方程式:(5)向
 溶液中通入适量的
溶液中通入适量的 单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
您最近半年使用:0次



