1 . 完成下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________
(2)①基态Cu原子有___________ 种不同能级的电子。位于在周期表___________ 区(填s、p、d或ds)。Cu+的价电子排布式为___________ 。
②N原子中最高能级的电子的电子云轮廓图为___________ 。
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ 。
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:___________ 。
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用___________ 盛装(填 酸式滴定管 或 碱式滴定管)滴定终点溶液的判断是___________ 颜色变化为由无色变为浅红色。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①基态Cu原子有
②N原子中最高能级的电子的电子云轮廓图为
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中
 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用
您最近一年使用:0次
名校
2 . X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。X的s轨道上电子全充满,p轨道上无电子,Y与Z相邻,Z是地壳中含量最丰富的元素,M为非金属性最强的元素,Q是纯碱中的一种元素,下列说法不正确 的是
A.第一电离能: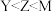 |
B.简单离子半径: |
C.化合物 可能为两性氢氧化物 可能为两性氢氧化物 |
| D.Z与Q形成化合物的化合物中可能含有非极性键 |
您最近一年使用:0次
2024-03-14更新
|
257次组卷
|
3卷引用:浙江省杭州市浙江大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 类推的思维方法在化学学习中应用广泛,但类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论错误的是
A. 能与 能与 溶液反应,则 溶液反应,则 也能与 也能与 溶液反应 溶液反应 |
B. 是“V形”分子,则 是“V形”分子,则 是“V形”分子 是“V形”分子 |
C.第二周期元素氢化物稳定性顺序是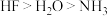 ,则第三周期元素氢化物稳定性顺序也是 ,则第三周期元素氢化物稳定性顺序也是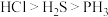 |
D.工业制 采用电解熔融 采用电解熔融 的方法,则工业制 的方法,则工业制 也可采用电解熔融 也可采用电解熔融 的方法 的方法 |
您最近一年使用:0次
2024-02-18更新
|
147次组卷
|
2卷引用:安徽省六安第一中学2023-2024学年高二上学期期末考试化学试题
名校
4 . 如图所示为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是___________ (填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是___________ (填离子符号)。
(2)某元素原子的价层电子排布式为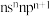 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为___________ ,该元素的第一电离能___________ (填“大于”“等于”或“小于”)原子的价层电子排布式为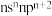 的元素。
的元素。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是___________ (填化学式)。
(5)下列各组微粒的空间结构相同的是___________ (填序号)。
① 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和

请回答下列问题:
(1)表中属于d区的元素是
(2)某元素原子的价层电子排布式为
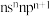 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为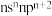 的元素。
的元素。(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是
(5)下列各组微粒的空间结构相同的是
①
 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和
您最近一年使用:0次
5 . 钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿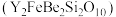 为原料生产氧化钇(
为原料生产氧化钇( )。
)。
(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为______ ,与 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种________ 。
(2)在元素周期表中, 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。
①写出 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:___________ 。
②已知 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(3) 与
与 均为第二周期元素:
均为第二周期元素:
① 元素的原子核外共有
元素的原子核外共有____ 种不同空间运动状态的电子。
②电离能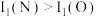 ,原因是
,原因是__________ 。
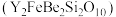 为原料生产氧化钇(
为原料生产氧化钇( )。
)。(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为
 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种(2)在元素周期表中,
 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。①写出
 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:②已知
 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是(3)
 与
与 均为第二周期元素:
均为第二周期元素:①
 元素的原子核外共有
元素的原子核外共有②电离能
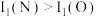 ,原因是
,原因是
您最近一年使用:0次
2024-01-06更新
|
368次组卷
|
3卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
6 . 有a、b、c、d、e、f、g七种元素,原子序数依次增大,前5种为短周期主族元素,f、g为第四周期的元素。有关信息如下,请回答以下问题:
(1)a、f的元素符号为______ 、______ ,分别位于元素周期表的______ 区和______ 区。
(2)e的基态原子中能量最高的电子所占的轨道形状是______ 其电子云在空间有______ 个伸展方向。
(3)d基态原子的价层电子的轨道表示式为______ ,某元素在元素周期表中位置处于d元素的左上角对角线处,它们具有部分相似的性质,请写出该元素组成的单质与氢氧化钠溶液反应的化学方程式______
(4)g基态原子的简化电子排布式为______
(5)元素f基态原子的第二电离能______ 元素g基态原子的第二电离能(填“>”、“<或“=”)
a | a能形成一种硬度最大的固体单质 |
b | b的单质为空气中百分含量最多的一种气体 |
c | c元素基态原子的电子排布式为 |
d | d基态原子的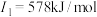 ; ; ; ; ; ; |
e | e基态原子核外3p轨道半满 |
f | f在周期表中第11纵行 |
g | g基态原子最外层电子数为2 |
(2)e的基态原子中能量最高的电子所占的轨道形状是
(3)d基态原子的价层电子的轨道表示式为
(4)g基态原子的简化电子排布式为
(5)元素f基态原子的第二电离能
您最近一年使用:0次
7 . 下列说法中错误的是
| A.根据对角线规则,B和Si的性质具有相似性 |
| B.电负性越大的原子,对键合电子的吸引力越大 |
C.气体单质分子中,一定含有 键 键 |
| D.金属焰色试验的原理是电子跃迁释放能量 |
您最近一年使用:0次
2023-12-26更新
|
340次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 下列说法中错误的是
| A.根据对角线规则,铍和铝的性质具有相似性 |
B.在H3O+、 和[Cu(NH3)4]2+中都存在配位键 和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.P4和CH4都是正四面体分子且都含有非极性键 |
您最近一年使用:0次
名校
9 . “类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是
| A.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2 |
| B.Na在空气中燃烧生成Na2O2,则同族的Li在空气中燃烧也生成Li2O2 |
| C.Al(OH)3溶于NaOH溶液生成Na[Al(OH)4],则Be(OH)2也能溶于NaOH溶液生成Na2[Be(OH)4] |
| D.Al3+与S2﹣在水溶液中因水解无法大量共存,则Fe3+与S2﹣在水溶液中也因水解无法大量共存 |
您最近一年使用:0次
2023-07-24更新
|
268次组卷
|
4卷引用:浙江省宁波市九校2022-2023学年高二上学期期末联考化学试题
名校
10 . 根据周期表中的对角线规则,下列有关推断错误的是
| A.BeO是两性氧化物 | B.Li在空气中燃烧可生成 和 和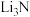 |
C. 是弱酸 是弱酸 | D.碱性: |
您最近一年使用:0次
2023-04-22更新
|
252次组卷
|
3卷引用:浙江省金华市十校2022-2023学年高二上学期期末考试化学试题



