1 . 青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________ 。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________ I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____ ,硫酸的结构式为_____ 。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________ ,影响△H2递变的因素为________ 。
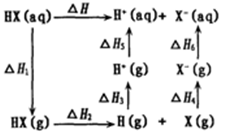
(1)在周期表中,与Si的化学性质最相似的邻族元素是
(2) Na+和 Ne互为等电子体,电离能 I2(Na)
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为
您最近一年使用:0次
名校
2 . 根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2和一种气体的离子方程式:______________________________________ 。
(2)Be(OH)2与Mg(OH)2可用__________ 试剂鉴别,其离子方程式为:______________________________ 。
(3)Li与Mg根据对角线规则,性质也相似,Li2CO3受热也易分解,请写出分解产物中金属氧化物的电子式_____________ ,它属于____________ 晶体。
(1)写出Be与NaOH溶液反应生成Na2BeO2和一种气体的离子方程式:
(2)Be(OH)2与Mg(OH)2可用
(3)Li与Mg根据对角线规则,性质也相似,Li2CO3受热也易分解,请写出分解产物中金属氧化物的电子式
您最近一年使用:0次
名校
3 . 下表为长式周期表的一部分,其中的编号代表对应的元素。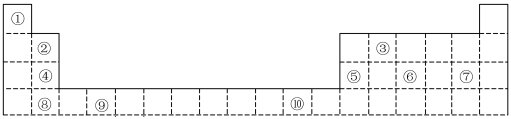
请回答下列问题:
(1)表中属于d区元素的是________ (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为____ ;③和⑦形成的一种常见溶剂的化学式为_____ 。
(3)元素④的第一电离能________ 元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________ 元素⑦(选填“>”、“=”或“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为________________ 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________ 。

请回答下列问题:
(1)表中属于d区元素的是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)元素④的第一电离能
(4)元素⑦和⑧形成的化合物的电子式为
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
您最近一年使用:0次
4 . 铍及其化合物的应用正日益被重视。在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成Li2O外,也生成微量的_________ (填化学式)。
(2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________________________________________ 。
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于________ (填“离子”或“共价”)化合物,写出它的一个等电子体_________ 。
(4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________ (标出配位键)。
(1)锂在空气中燃烧,除生成Li2O外,也生成微量的
(2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于
(4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为
您最近一年使用:0次
5 . 下表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
六种元素中,若b为非金属元素,则以下推断正确的是_________ (选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
| a | b | c |
| d | e | f |
六种元素中,若b为非金属元素,则以下推断正确的是
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
您最近一年使用:0次
6 . 下表为元素周期表的一部分,其中的编号代表对应的元素。
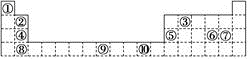
请回答下列问题:
(1)表中属于ds区的元素是________ (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为________ 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为________ 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______________________ 。
(5)画出⑨的外围电子排布图____________________________ .

请回答下列问题:
(1)表中属于ds区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
(5)画出⑨的外围电子排布图
您最近一年使用:0次
名校
7 . 化学的特征之一是从微观的层面认识物质。通过结合元素周期表与周期律,建立“位置·结构·性质”思维模型,我们可以更好地认识物质世界。
(一) X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
(1)X在周期表中的位置是________ ;Y、Q各自形成的简单离子中,半径较大的是______ (填离子符号)。W和R按原子个数比1:4构成的阳离子中所含的化学键类型为_________ 。
(2)M与Z相比,非金属性较强的是____________ (填元素名称),两元素最高价氧化物的水化物中,酸性较强的是________________ (填化学式)。
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是___________ ,同时生成微量的________ 、______ (写化学式)。
(4)下列关于铍的判断正确的是___________
A.氧化铍的化学式为Be2O3 B.Be(OH)2可溶于水
C.BeCl2是离子化合物 D.Be(OH)2具有两性
(5)Be(OH)2和Mg(OH)2可用试剂________________ 鉴别。
(一) X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:

(1)X在周期表中的位置是
(2)M与Z相比,非金属性较强的是
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是
(4)下列关于铍的判断正确的是
A.氧化铍的化学式为Be2O3 B.Be(OH)2可溶于水
C.BeCl2是离子化合物 D.Be(OH)2具有两性
(5)Be(OH)2和Mg(OH)2可用试剂
您最近一年使用:0次
8 . 根据元素周期表和周期律相关知识,回答下列问题:
(1)C、N、O三种元素中电负性最大的是_______ ,第一电离能最大的是_______ ;
(2)①O2-,②Al3+,③Cl-,④Ca2+的半径由大到小排列为:________________ (用序号表示);
(3)元素非金属性Cl______ S(填“>”或“<”),请举例证明:____________________ (可用方程式或客观事实回答);
(4)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:________________________________ 。
(1)C、N、O三种元素中电负性最大的是
(2)①O2-,②Al3+,③Cl-,④Ca2+的半径由大到小排列为:
(3)元素非金属性Cl
(4)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
您最近一年使用:0次
名校
9 . 根据周期表对角线规则,回答下列问题:
(1)写出Be(OH)2与盐酸和氢氧化钠溶液分别反应的离子方程式:_______ ,__________ 。
(2)BeCl2溶液和MgCl2溶液可用试剂______________ 加以鉴别,依据的实验现象是_____________ 。
(1)写出Be(OH)2与盐酸和氢氧化钠溶液分别反应的离子方程式:
(2)BeCl2溶液和MgCl2溶液可用试剂
您最近一年使用:0次
10 . 下图是元素周期表的一部分

(1)②号元素原子的电子式_________________
(2)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式___________________________
(3)元素③和⑤可以原子个数比1:2 形成化合物,请在①-⑩号元素中选择元素组合,写出与它互为等电子体的一种分于化学式___________ 、一种离子的化学式__________________ 。
(4)⑩号元素的+3 价离子能与④、⑤的氢化物形成配位数为6 的络合物。且相应两种配体的物质的量之比为2:1,写出配离子的化学式_________________________ 。

(1)②号元素原子的电子式
(2)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式
(3)元素③和⑤可以原子个数比1:2 形成化合物,请在①-⑩号元素中选择元素组合,写出与它互为等电子体的一种分于化学式
(4)⑩号元素的+3 价离子能与④、⑤的氢化物形成配位数为6 的络合物。且相应两种配体的物质的量之比为2:1,写出配离子的化学式
您最近一年使用:0次



