名校
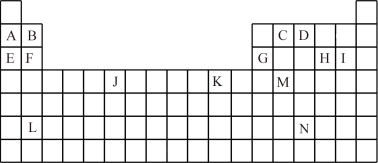
1 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
(1)写出基态时J的价层电子排布式_____ ,L的原子序数为____ ,K的+2离子的价层电子的轨道表示式_____ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是_____。
(3)G元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程式是______ 。
(4)根据对角线规则及已知元素性质,推测A元素的单质与氧气在点燃时反应生成的物质为_______ (填化学式)。
(5)D的简单气态氢化物的 构型为
构型为______ ,它极易溶于水,原因是_______ 。
(1)写出基态时J的价层电子排布式
(2)下列关于元素在元素周期表中的位置的叙述正确的是_____。
| A.M位于元素周期表中第四周期ⅥA族,属于p区元素 |
| B.J位于元素周期表中第四周期ⅣB族,属于d区元素 |
| C.F位于元素周期表中第三周期ⅡA族,属于s区元素 |
| D.I位于元素周期表中第三周期ⅦA族,属于ds区元素 |
(3)G元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程式是
(4)根据对角线规则及已知元素性质,推测A元素的单质与氧气在点燃时反应生成的物质为
(5)D的简单气态氢化物的
 构型为
构型为
您最近一年使用:0次
2 . 中国科学院化学研究所有机固体院重点实验室合成了适用于非卤溶剂加工的“巨分子受体”,对于推动聚合物太阳电池受体光伏材料的发展具有重要意义。目前可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,其基态原子有_______ 种不同运动状态的电子。
(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为_______ ,其核外电子占据的最高能级的电子云轮廓图为_______ 。
(3)第一电子亲和能 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
_______ (填“ ”或“
”或“ ”)
”) 。
。
(4) 和
和 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是_______ (填元素符号),试解释其原因:_______ 。
(5)根据对角线规则可知, 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为
(3)第一电子亲和能
 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
 ”或“
”或“ ”)
”) 。
。(4)
 和
和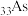 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是(5)根据对角线规则可知,
 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)②元素原子的电子式是:_______ 。
(2)硅元素在周期表中的位置是:第_______ 周期_______ 族。
(3)如图所示钾元素的部分信息,“30.97”数值表示_______ 。______ (填元素符号)。③和⑧两种元素形成的气态氢化物稳定性强的是_______ (填化学式)。写出④的最高价氧化物对应水合物和⑧的最高价氧化物对应水合物相互反应的化学方程式_______ 。
(5)Cl元素比S元素的非金属性强,请从原子结构角度解释原因_______ 。能证明这一事实的化学反应为_______ (写一个化学方程式)。
(6)能证明O元素的非金属性强于S元素的依据是_______ 。
A.热稳定性:H2O>H2S B.SO2中O显负价 C.沸点:S>O2
(7)氧元素有三种核素:16O、17O、18O,对这三种核素的描述错误的是_______ 。
(8)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是_______ 。
(9)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。下列叙述错误的是_______ 。
族 周期 | ⅠA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)②元素原子的电子式是:
(2)硅元素在周期表中的位置是:第
(3)如图所示钾元素的部分信息,“30.97”数值表示
(5)Cl元素比S元素的非金属性强,请从原子结构角度解释原因
(6)能证明O元素的非金属性强于S元素的依据是
A.热稳定性:H2O>H2S B.SO2中O显负价 C.沸点:S>O2
(7)氧元素有三种核素:16O、17O、18O,对这三种核素的描述错误的是
| A.质子数相同 | B.质量相同 |
| C.化学性质相同 | D.位置相同(周期表中) |
(8)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是
| A.在周期表中金属与非金属的分界处可以找到催化剂材料 |
| B.对氟、氯、硫、磷、砷等元素的研究,有助于制造出新品种的农药 |
| C.在过渡元素中可寻找制造半导体的元素 |
| D.可在第IA、IIA族元素中寻找制造耐高温、耐腐蚀合金的元素 |
(9)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。下列叙述错误的是
| A.Li在空气中燃烧生成Li2O、Li3N | B.硼酸是弱酸 |
| C.Be不与水反应 | D.Be(OH)2是两性氢氧化物 |
您最近一年使用:0次
名校
解题方法
4 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。回答下列问题:
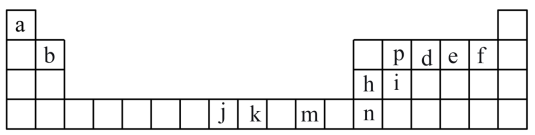
(1)下列正确的是___________。
(2)已知高温下化合物 比化合物
比化合物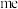 更稳定,试从
更稳定,试从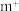 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因___________ 。
(3)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(4)下图为第ⅤA族、ⅥA、ⅦA族元素简单氢化物沸点随周期数的递变趋势图。

分析上图回答下列问题:
①推测ⅣA族 与
与 的沸点大小为
的沸点大小为
___________  (填“>”或“<”)。
(填“>”或“<”)。
②接近水的沸点的水蒸气的相对分子质量测定值比按化学式 计算出的相对分子质量大一些,原因为
计算出的相对分子质量大一些,原因为___________ 。
③ 常用于制备半导体材料,
常用于制备半导体材料, 与足量的
与足量的 加热可反应得到
加热可反应得到 ,通过
,通过___________ 的实验分析方法可测出 的键长键角信息。
的键长键角信息。

(1)下列正确的是___________。
A.原子半径 | B.第一电离能 |
C.电负性 | D.最高价氧化物的水化物的酸性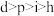 |
 比化合物
比化合物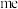 更稳定,试从
更稳定,试从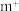 离子的核外电子排布的角度解释原因
离子的核外电子排布的角度解释原因(3)根据对角线规则,b与h的化学性质相似,请写出b的最高价氧化物对应的水化物与
 溶液反应的离子方程式
溶液反应的离子方程式(4)下图为第ⅤA族、ⅥA、ⅦA族元素简单氢化物沸点随周期数的递变趋势图。

分析上图回答下列问题:
①推测ⅣA族
 与
与 的沸点大小为
的沸点大小为
 (填“>”或“<”)。
(填“>”或“<”)。②接近水的沸点的水蒸气的相对分子质量测定值比按化学式
 计算出的相对分子质量大一些,原因为
计算出的相对分子质量大一些,原因为③
 常用于制备半导体材料,
常用于制备半导体材料, 与足量的
与足量的 加热可反应得到
加热可反应得到 ,通过
,通过 的键长键角信息。
的键长键角信息。
您最近一年使用:0次
名校
5 . 如图所示为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是___________ (填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是___________ (填离子符号)。
(2)某元素原子的价层电子排布式为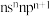 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为___________ ,该元素的第一电离能___________ (填“大于”“等于”或“小于”)原子的价层电子排布式为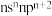 的元素。
的元素。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是___________ (填化学式)。
(5)下列各组微粒的空间结构相同的是___________ (填序号)。
① 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和

请回答下列问题:
(1)表中属于d区的元素是
(2)某元素原子的价层电子排布式为
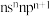 ,该元素原子的最外层电子的孤电子对数为
,该元素原子的最外层电子的孤电子对数为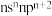 的元素。
的元素。(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是
(5)下列各组微粒的空间结构相同的是
①
 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 和
和 ⑦
⑦ 和
和
您最近一年使用:0次
6 . 有a、b、c、d、e、f、g七种元素,原子序数依次增大,前5种为短周期主族元素,f、g为第四周期的元素。有关信息如下,请回答以下问题:
(1)a、f的元素符号为______ 、______ ,分别位于元素周期表的______ 区和______ 区。
(2)e的基态原子中能量最高的电子所占的轨道形状是______ 其电子云在空间有______ 个伸展方向。
(3)d基态原子的价层电子的轨道表示式为______ ,某元素在元素周期表中位置处于d元素的左上角对角线处,它们具有部分相似的性质,请写出该元素组成的单质与氢氧化钠溶液反应的化学方程式______
(4)g基态原子的简化电子排布式为______
(5)元素f基态原子的第二电离能______ 元素g基态原子的第二电离能(填“>”、“<或“=”)
a | a能形成一种硬度最大的固体单质 |
b | b的单质为空气中百分含量最多的一种气体 |
c | c元素基态原子的电子排布式为 |
d | d基态原子的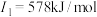 ; ; ; ; ; ; |
e | e基态原子核外3p轨道半满 |
f | f在周期表中第11纵行 |
g | g基态原子最外层电子数为2 |
(2)e的基态原子中能量最高的电子所占的轨道形状是
(3)d基态原子的价层电子的轨道表示式为
(4)g基态原子的简化电子排布式为
(5)元素f基态原子的第二电离能
您最近一年使用:0次
解题方法
7 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子中,占据最高能级电子的电子云轮廓图形状为___________ 。
(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是___________ 。
(ii)离子半径:Li+___________ H-(填“>”“=”或“<”)。
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
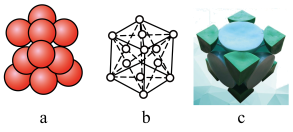
(i)晶胞中锂的配位数为___________ 。
(ii)若锂原子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为___________  (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是
(ii)离子半径:Li+
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:

(i)晶胞中锂的配位数为
(ii)若锂原子的半径为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为 (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2023-10-28更新
|
92次组卷
|
2卷引用:山西省大同市2023-2024学年高三上学期10月月考化学试题
名校
8 . 下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③基态原子的核外电子轨道表示式是___________ 。
(2)写出元素⑩的一价离子的核外电子排布式:___________ ,该元素属于___________ 区元素。
(3)由元素④构成的三原子分子的空间结构为___________ 。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:___________ (填化学式)。
(5)③与①以原子个数比为 形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为
形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为___________ ,X为___________ (极性分子或非极性分子)
(6)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑨ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
| ⑩ | |||||||||||||||||
(1)③基态原子的核外电子轨道表示式是
(2)写出元素⑩的一价离子的核外电子排布式:
(3)由元素④构成的三原子分子的空间结构为
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:
(5)③与①以原子个数比为
 形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为
形成的化合物X可用于火箭发射的燃料,其中③的杂化轨道类型为(6)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式
您最近一年使用:0次
9 . 如图所示为元素周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________ (填编号);④⑤⑥⑦⑧五种元素形成的稳定离子中,离子半径最小的是________ (填离子符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子的空间结构为________ 。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与 溶液反应的化学方程式:
溶液反应的化学方程式:________ 。
(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是________ (填化学式)。
(5)下列各组微粒的空间结构相同的是________ (填序号)。
① 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 、
、 和
和
(6)有两种活性反应中间体粒子,它们的粒子中均含有元素③的1个原子和元素①的3个原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
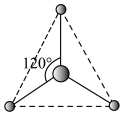
________________ ;
________________ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子的空间结构为
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与
 溶液反应的化学方程式:
溶液反应的化学方程式:(4)上述10种元素形成的最高价氧化物对应水化物中,酸性最强的是
(5)下列各组微粒的空间结构相同的是
①
 和
和 ②
② 和
和 ③
③ 和
和 ④
④ 和
和 ⑤
⑤ 和
和 ⑥
⑥ 、
、 和
和
(6)有两种活性反应中间体粒子,它们的粒子中均含有元素③的1个原子和元素①的3个原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:


您最近一年使用:0次
10 . 如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。

(1)请写出 区铜原子基态电子排布式
区铜原子基态电子排布式_______
(2)同主族元素的第一电离能的变化规律是_______
(3)图中第一电离能最小的元素在周期表中的位置是_______
(4)根据对角线规则,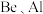 的最高价氧化物对应水化物的性质相似,它们都具有
的最高价氧化物对应水化物的性质相似,它们都具有_______ 性,能证明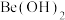 该性质的实验结论是
该性质的实验结论是_______
(5) 元素中,某元素M电离能如表所示:
元素中,某元素M电离能如表所示:
①由此判断该元素是_______ (填元素符号);
②分析图中同周期元素第一电离能的变化规律,推断: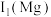
_______  。
。

(1)请写出
 区铜原子基态电子排布式
区铜原子基态电子排布式(2)同主族元素的第一电离能的变化规律是
(3)图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,
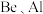 的最高价氧化物对应水化物的性质相似,它们都具有
的最高价氧化物对应水化物的性质相似,它们都具有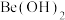 该性质的实验结论是
该性质的实验结论是(5)
 元素中,某元素M电离能如表所示:
元素中,某元素M电离能如表所示: | 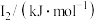 | 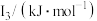 | 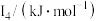 | 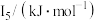 |
| 578 | 1817 | 2745 | 11575 | 14830 |
②分析图中同周期元素第一电离能的变化规律,推断:
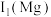
 。
。
您最近一年使用:0次



