1 . 如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。

(1)请写出 区铜原子基态电子排布式
区铜原子基态电子排布式_______
(2)同主族元素的第一电离能的变化规律是_______
(3)图中第一电离能最小的元素在周期表中的位置是_______
(4)根据对角线规则,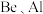 的最高价氧化物对应水化物的性质相似,它们都具有
的最高价氧化物对应水化物的性质相似,它们都具有_______ 性,能证明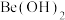 该性质的实验结论是
该性质的实验结论是_______
(5) 元素中,某元素M电离能如表所示:
元素中,某元素M电离能如表所示:
①由此判断该元素是_______ (填元素符号);
②分析图中同周期元素第一电离能的变化规律,推断: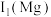
_______  。
。

(1)请写出
 区铜原子基态电子排布式
区铜原子基态电子排布式(2)同主族元素的第一电离能的变化规律是
(3)图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,
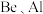 的最高价氧化物对应水化物的性质相似,它们都具有
的最高价氧化物对应水化物的性质相似,它们都具有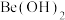 该性质的实验结论是
该性质的实验结论是(5)
 元素中,某元素M电离能如表所示:
元素中,某元素M电离能如表所示: | 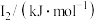 | 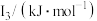 | 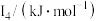 | 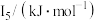 |
| 578 | 1817 | 2745 | 11575 | 14830 |
②分析图中同周期元素第一电离能的变化规律,推断:
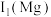
 。
。
您最近一年使用:0次
2 . 元素周期表是指导我们学习元素及其化合物知识的重要工具,除了同周期、同主族元素的变化规律外,某些主族元素与右下方的主族元素的性质相似,称为对角线规则,如钠与钙的化学性质相似。已知碱土金属元素铍(Be)、镁、钙、锶、钡是周期表中第IIA族从上到下排列的元素。
回答下列问题:
(1)锶元素的化合价为_______ ,从铍到钡的金属性逐渐_______ ;从原子结构角度分析,碱土金属元素化学性质相似的原因是_______ 。
(2)预测氢氧化锶属于_______ (填“强”或“弱”)碱,写出金属钙与水反应的化学方程式_______ 。
(3)铍元素与铝的化学性质相似,氢氧化铍具有两性,难溶于水,写出氢氧化铍与氢氧化钠溶液反应的离子方程式_______ 。
(4)过氧化钡化学式为BaO2,其电子式为_______ ,实验室常用BaO2与稀硫酸反应制备过氧化氢,写出反应的化学方程式_______ 。
回答下列问题:
(1)锶元素的化合价为
(2)预测氢氧化锶属于
(3)铍元素与铝的化学性质相似,氢氧化铍具有两性,难溶于水,写出氢氧化铍与氢氧化钠溶液反应的离子方程式
(4)过氧化钡化学式为BaO2,其电子式为
您最近一年使用:0次
解题方法
3 . 根据下列事实或数据回答下列问题:
(1)指南针是我国四大发明之一,其指针含有Fe3O4,写出基态Fe原子的电子排布式_______ ,基态Fe2+中未成对的电子数有_______ 个,基态O2-离子核外电子占据的最高能级共有_______ 个原子轨道。
(2)下列四种元素是第三或第四周期主族元素,其中X、Y、Z是同一周期元素,下表是这四种元素的第一电离能(I1)到第四电离能(I4)的数据(单位∶kJ·mol-1 )。
①推断Y可能是元素周期表_______ 区元素(填写“s或p或d或ds或f”)。
②由表中数据,推测Z元素的化合价_______ ,推断的理由是_______ 。
③推测X、Y、Z、W元素的原子半径从小到大的顺序是_______ 。
④Z的第一电离能比Y小的原因是_______ 。
(3)根据对角线规则,写出氢氧化铍与氢氧化钠溶液反应的化学方程式_______ 。
(1)指南针是我国四大发明之一,其指针含有Fe3O4,写出基态Fe原子的电子排布式
(2)下列四种元素是第三或第四周期主族元素,其中X、Y、Z是同一周期元素,下表是这四种元素的第一电离能(I1)到第四电离能(I4)的数据(单位∶kJ·mol-1 )。
| 元素代号 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 740 | 1500 | 7700 | 10500 |
| Z | 580 | 1800 | 2700 | 11600 |
| W | 420 | 3100 | 4400 | 5900 |
②由表中数据,推测Z元素的化合价
③推测X、Y、Z、W元素的原子半径从小到大的顺序是
④Z的第一电离能比Y小的原因是
(3)根据对角线规则,写出氢氧化铍与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
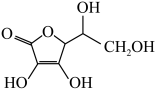
4 . 磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂离子电池正极材料。回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是_____ ,基态O原子的价电子轨道表示式为_____ 。
(2)原子核外电子有两种相反的自旋状态,分别用+ 和-
和- 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为_____ 。基态Fe元素的价电子排布式为_____ 。
(3)PO 的空间结构为
的空间结构为_____ 形,其中心原子的杂化轨道类型为_____ 。
(4)PH3和NH3相比,_____ 更易液化;C、N、O元素的第一电离能由大到小的顺序为_____ 。
(5)NH4H2PO4中,电负性最高的元素是_____ ;P的_____ 杂化轨道与O的2p轨道形成_____ 键。(填σ或π)
(6)CO 的空间构型为
的空间构型为_____ (用文字描述);抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_____ ;推测抗坏血酸在水中的溶解性:_____ (填“难溶于水”或“易溶于水”)。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)原子核外电子有两种相反的自旋状态,分别用+
 和-
和- 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(3)PO
 的空间结构为
的空间结构为(4)PH3和NH3相比,
(5)NH4H2PO4中,电负性最高的元素是
(6)CO
 的空间构型为
的空间构型为
您最近一年使用:0次
5 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)写出元素⑩的一价离子的核外电子排布式:_______ 该元素属于_______ 区元素。
(2)在标号的主族元素中,电负性最大的是_______ (填元素符号,下同),第一电离能最小的是_______ 。
(3)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:_______ (填化学式)。
(4)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑨ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
| ⑩ |
(1)写出元素⑩的一价离子的核外电子排布式:
(2)在标号的主族元素中,电负性最大的是
(3)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:
(4)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式
您最近一年使用:0次
名校
6 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:___________ B:___________ G___________ ,写出元素B的基态原子的轨道表示式:___________ 。
(2)C、D、E三种元素的原子半径由大到小的顺序___________ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:___________ ,___________ ,___________ ,其中C的简单气态氢化物的键角为:___________ 。
(4)已知元素A、B形成的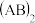 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为___________ 。
(5)F元素的简单阴离子结构示意图___________ 。电解D与F形成的化合物的水溶液在工业上有着重要应用,试写出其电解的总的化学反应方程式:___________ 。
(6)元素G位于周期表的___________ 区,其价电子的排布式为:___________ ,该元素可形成 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(7)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”)。推测M的最高价氧化物对应水化物___________ (填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为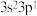 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)C、D、E三种元素的原子半径由大到小的顺序
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
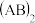 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为(5)F元素的简单阴离子结构示意图
(6)元素G位于周期表的
 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(7)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
2022-03-03更新
|
652次组卷
|
2卷引用:天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题
7 . 如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序是_______ (用元素符号表示)。
(2)请写出①和⑨两种元素形成的10电子分子的电子式_______ 。
(3)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是_______ (填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式:_______ 。
(5)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:_______ 。
| IA | 0 | |||||||
| 一 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 二 | ⑧ | ⑨ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)请写出①和⑨两种元素形成的10电子分子的电子式
(3)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式:
(5)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:
您最近一年使用:0次
2021-07-07更新
|
104次组卷
|
2卷引用:四川省广安市2020-2021学年高一下学期期末考试化学试题
名校
8 . 化学的特征之一是从微观的层面认识物质。通过结合元素周期表与周期律,建立“位置一结构一性质”思维模型,我们可以更好地认识物质世界。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
(1)X在周期表中的位置是_______ ;Y、Q各自形成的简单离子中,半径较大的是_______ (填离子符号)。W和R按原子个数比1:4构成的阳离子中所含的化学键类型为_______ 。
(2)M与Z相比,非金属性较强的是_______ (填元素名称),两元素最高价氧化物的水化物中,酸性较强的是_______ (填化学式)。
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是_______ 。
(4)下列关于铍的判断正确的是( )
A.氧化铍的化学式为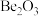 B.
B. 易溶于水
易溶于水
C. 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性
(5) 和
和 可用试剂
可用试剂_______ 鉴别。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
| 元素代号 | X | Y(铝) | Z | M | W | Q | R |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.070 | 0.074 | 0.037 |
| 主要化合价 | +1 | +3 | +6,-2 | +7,-1 | +5,-3 | -2 | +1 |
(2)M与Z相比,非金属性较强的是
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是
(4)下列关于铍的判断正确的是
A.氧化铍的化学式为
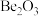 B.
B. 易溶于水
易溶于水C.
 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性(5)
 和
和 可用试剂
可用试剂
您最近一年使用:0次
2021-04-01更新
|
113次组卷
|
2卷引用:河南省上蔡第一高级中学2022-2023学年高一上学期期末考试化学试题
解题方法
9 . 回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
①判断下列化合物中属于离子化合物的是________ (填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________ ;NCl3水解产物为____________________ 。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
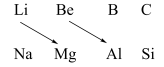
①铍的最高价氧化物的水化物是________ (填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________ ;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________ (用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
①外层电子离核越远,能量越高,电离能越__________ (填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________ (填“大”或“小”);
②上述11个电子分属________ 个电子层;
③失去了11个电子后,该元素还有________ 个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________ 。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
①判断下列化合物中属于离子化合物的是
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:

①铍的最高价氧化物的水化物是
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | …… |
| 电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | …… |
①外层电子离核越远,能量越高,电离能越
②上述11个电子分属
③失去了11个电子后,该元素还有
④该元素最高价氧化物对应水化物的化学式是
您最近一年使用:0次
2020-02-05更新
|
138次组卷
|
2卷引用:云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题
解题方法
10 . 因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________ 。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________ 。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________ ,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________ 。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________ 种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________ 。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+( )__________ 。
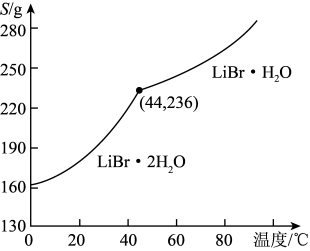
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____ 、过滤、用乙醇洗涤,干燥。
(1)锂位于元素周期表的
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+( )
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:

您最近一年使用:0次
2019-01-14更新
|
237次组卷
|
3卷引用:【区级联考】上海市杨浦区2019届高三上学期等级考试模拟(期末)化学试题



