2021高三·全国·专题练习
1 . 回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(2)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
①Fe成为阳离子时首先失去___________ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为___________ 。
②比较离子半径:F___________ O2-(填“大于”“等于”或“小于”)。
(3)在周期表中,与Li的化学性质最相似的邻族元素是___________ ,该元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”)。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.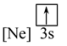 | B.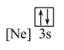 | C.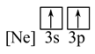 | D.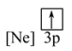 |
①Fe成为阳离子时首先失去
②比较离子半径:F
(3)在周期表中,与Li的化学性质最相似的邻族元素是
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
2 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是___________ 。根据对角线规则,B的一些化学性质与元素___________ 的相似。
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是___________ 。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
您最近一年使用:0次
解题方法
3 . 《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为 。
。
回答下列问题:
(1)钠在周期表中的位置是___________ ;质子数与中子数相等的硅原子符号为___________ ;钙离子的结构示意图为___________ 。
(2) 的电子式为
的电子式为___________ , 的电子式为
的电子式为___________ 。
(3) 与
与 的化学性质相似,则
的化学性质相似,则 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是___________
(4)宏观辨识与微观探析是化学学科的核心素养之一、下列能说明 的非金属性比S强的事实是
的非金属性比S强的事实是___________ (填标号)。
A.氯、硫的最低负价分别为 、
、 B.
B. 中氯显
中氯显 价,硫显
价,硫显 价
价
C.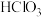 的酸性比
的酸性比 的强 D.向
的强 D.向 水溶液中通入
水溶液中通入 有淡黄色沉淀生成
有淡黄色沉淀生成
E.硫化氢在 时开始分解,
时开始分解, 在
在 时开始缓慢分解
时开始缓慢分解
 。
。回答下列问题:
(1)钠在周期表中的位置是
(2)
 的电子式为
的电子式为 的电子式为
的电子式为(3)
 与
与 的化学性质相似,则
的化学性质相似,则 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是(4)宏观辨识与微观探析是化学学科的核心素养之一、下列能说明
 的非金属性比S强的事实是
的非金属性比S强的事实是A.氯、硫的最低负价分别为
 、
、 B.
B. 中氯显
中氯显 价,硫显
价,硫显 价
价C.
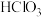 的酸性比
的酸性比 的强 D.向
的强 D.向 水溶液中通入
水溶液中通入 有淡黄色沉淀生成
有淡黄色沉淀生成E.硫化氢在
 时开始分解,
时开始分解, 在
在 时开始缓慢分解
时开始缓慢分解
您最近一年使用:0次
名校
解题方法
4 . 依据元素周期表与元素周期律回答以下问题:
(1)根据元素周期表对角线规则,金属Be与Al单质及其化合物性质相似。写出Be与 溶液反应离子方程式:
溶液反应离子方程式:_______ 。
(2)硒(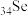 )和S位于同一主族。
)和S位于同一主族。 的稳定性比
的稳定性比 的
的_______ (填“强”或“弱”,断开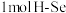 键吸收的能量比断开
键吸收的能量比断开 键吸收的能量
键吸收的能量_______ (填“多”或“少”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下_______ 。
(3)氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)为元素周期表原子序数依次增大的同族元素。回答下列问题:
①砷在元素周期表中的位置_______ 。
② 的电子式为
的电子式为_______ ,沸点:
_______ 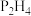 (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是_______ 。
③ 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应所得产物的推断正确的是
反应所得产物的推断正确的是_______ (填序号)。
a.只含共价键 b.难于水 c.受热易分解 d.能与 溶液反应
溶液反应
(1)根据元素周期表对角线规则,金属Be与Al单质及其化合物性质相似。写出Be与
 溶液反应离子方程式:
溶液反应离子方程式:(2)硒(
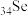 )和S位于同一主族。
)和S位于同一主族。 的稳定性比
的稳定性比 的
的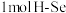 键吸收的能量比断开
键吸收的能量比断开 键吸收的能量
键吸收的能量(3)氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)为元素周期表原子序数依次增大的同族元素。回答下列问题:
①砷在元素周期表中的位置
②
 的电子式为
的电子式为
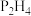 (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是③
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应所得产物的推断正确的是
反应所得产物的推断正确的是a.只含共价键 b.难于水 c.受热易分解 d.能与
 溶液反应
溶液反应
您最近一年使用:0次
5 . 磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。在周期表中,与Li的化学性质最相似的邻族元素是___________ ,该元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”)。
您最近一年使用:0次
6 . 在周期表中,与Li的化学性质最相似的邻族元素是__ ,该元素基态原子核外M层电子的自旋状态__ (填“相同”或“相反”)。
您最近一年使用:0次
2021-02-19更新
|
837次组卷
|
5卷引用:(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区
(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)01 常考题空1 电子排布、电离能与电负性 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
7 . 硼及其化合物在工农业生产中应用广泛。回答下列问题:
(1)硼元素在周期表中的位置是_______ 。
(2)无定形硼化学性质比较活泼,可与热的浓硫酸反应生成硼酸(H3BO3),该反应的化学方程式为_______ 。
(3)硼酸(H3BO3)是一种一元弱酸,硼酸溶于水可结合水电离出的OH-而释放出H+,表示这一变化的离子方程式为_______ ;H3BO3的酸性比H2CO2的酸性_______ (填“强”或“弱”)。
(4)NaBH4是一种重要的储氢载体。NaBH4中所含的化学键的类型有_______ ,NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_______ 。
(1)硼元素在周期表中的位置是
(2)无定形硼化学性质比较活泼,可与热的浓硫酸反应生成硼酸(H3BO3),该反应的化学方程式为
(3)硼酸(H3BO3)是一种一元弱酸,硼酸溶于水可结合水电离出的OH-而释放出H+,表示这一变化的离子方程式为
(4)NaBH4是一种重要的储氢载体。NaBH4中所含的化学键的类型有
您最近一年使用:0次
8 . (1)碳原子2p亚层上的2个电子不相同的方面是____ (选填序号)。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________ 。
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是______ (选填序号)。
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式____________________________ 。
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为_______ 。
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s) 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ①
2C(s)+ O2(g) 2CO(g) ②
2CO(g) ②
2Al(g)+N2(g) 2AlN(s) ③
2AlN(s) ③
试分析反应②对制备AlN的作用______________________________________________ 。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s)
 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ① 2C(s)+ O2(g)
 2CO(g) ②
2CO(g) ②2Al(g)+N2(g)
 2AlN(s) ③
2AlN(s) ③试分析反应②对制备AlN的作用
您最近一年使用:0次
9 . 2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_____ 。
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____ 。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(1)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
您最近一年使用:0次
10 . (1)按要求写出电子式:CO2_________ COCl2_________ NaCN______ N2H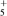
_______
(2)元素周期表中“对角线规则”是指处于周期表中对角线位置(左上和右下方)的两元素,其性质具有相似性,例如:Be和Al处于对角线位置。写出Be与氢氧化钠溶液反应的化学方程式:_________________________________ 。
(3)写出氢,氧,钠,硫四种元素组成的两种酸式盐发生复分解反应的离子方程式:___________________ 。
(2)元素周期表中“对角线规则”是指处于周期表中对角线位置(左上和右下方)的两元素,其性质具有相似性,例如:Be和Al处于对角线位置。写出Be与氢氧化钠溶液反应的化学方程式:
(3)写出氢,氧,钠,硫四种元素组成的两种酸式盐发生复分解反应的离子方程式:
您最近一年使用:0次



