名校
1 . (Ⅰ)如表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
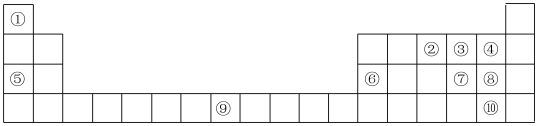
(1)元素②和④的简单氢化物反应生成化合物的电子式为_______ 。
(2)元素⑤和③的单质加热生成产物中含有的化学键类型为_______ 。
(3)元素⑨在周期表中的位置是_______ 。
(Ⅱ)L、M、N、Q、R、T分别代表上述十种元素之一,其原子半径及主要化合价关系如表:
(4)写出M最高价氧化物对应的水化物与N的最高价含氧酸反应的化学方程式:________ 。
(5)用一个离子方程式证明N和Q两元素的非金属性强弱:_______ 。
(6)R与T形成的简单氢化物的沸点较高的是:_______ (填化学式)。
(7)L、M、Q、R四种元素形成的简单离子半径从大到小的顺序为_______ (用相应的离子符号表示)。

(1)元素②和④的简单氢化物反应生成化合物的电子式为
(2)元素⑤和③的单质加热生成产物中含有的化学键类型为
(3)元素⑨在周期表中的位置是
(Ⅱ)L、M、N、Q、R、T分别代表上述十种元素之一,其原子半径及主要化合价关系如表:
| 元素代号 | L | M | N | Q | R | T |
| 原子半径/nm | 0.186 | 0.143 | 0.099 | 0.114 | 0.104 | 0.066 |
| 主要化合价 | +1 | +3 | +7、-1 | +7、-1 | +6、-2 | -2 |
(4)写出M最高价氧化物对应的水化物与N的最高价含氧酸反应的化学方程式:
(5)用一个离子方程式证明N和Q两元素的非金属性强弱:
(6)R与T形成的简单氢化物的沸点较高的是:
(7)L、M、Q、R四种元素形成的简单离子半径从大到小的顺序为
您最近一年使用:0次
2 . X、Y、Z、W、R为五种短周期主族元素,原子序数依次增大,Y、Z、W为同周期相邻元素,且最外层电子数之和为15.X比Y少一个电子层。R的原子序数是W的二倍。下列说法正确的是
| A.由X、Z、W三种元素形成的化合物的水溶液一定显酸性 |
| B.试管内壁残留的单质R可用Y和R形成的化合物去除,体现R的物理性质 |
| C.Y与W、Z与W形成的化合物都是大气污染物 |
| D.简单离子半径:R>W>Z |
您最近一年使用:0次
2024-02-01更新
|
195次组卷
|
2卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高一上学期期末考试化学试题
解题方法
3 . 部分短周期元素原子半径、最高正化合价或最低负化合价随原子序数的变化关系如图所示,下列叙述正确的是
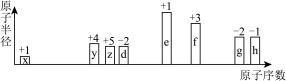

A.简单离子半径: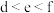 | B.电负性: |
C.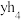 分子空间结构为正四面体形,为非极性分子 分子空间结构为正四面体形,为非极性分子 | D.物质的沸点: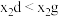 |
您最近一年使用:0次
4 . 某些短周期元素的数据如下表(已知Be的原子半径为0.089nm)。
回答下列问题:
(1)①在周期表中的位置是___________ 。
(2)上述第三周期元素中,最高价氧化物对应水化物酸性最强的是___________ (填酸的化学式)。
(3)①、②、⑤对应的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4)用电子式表示②、⑤组成化合物的形成过程___________ 。
(5)④、⑥的最高价氧化物对应水化物相互反应的化学方程式为___________ 。
(6)由⑤、⑧组成,每个原子均满足最外层8电子稳定结构的化合物的结构式为___________ 。
(7)下列说法错误的是___________ (填标号)。
a.最简单气态氢化物的稳定性①>⑦>⑧
b.最高价氧化物对应水化物的碱性②>④
c.与⑧号元素同主族的第四周期元素的单质是半导体材料
d.③号元素的单质在氧气中加热可以得到两种氧化物
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.143 | 0.099 | 0.186 | 0.075 | 0.077 |
| 最高正化合价 | +2 | +1 | +3 | +7 | +1 | +5 | +4 | |
| 最低负化合价 | -2 | -1 | -3 | -4 |
(1)①在周期表中的位置是
(2)上述第三周期元素中,最高价氧化物对应水化物酸性最强的是
(3)①、②、⑤对应的简单离子半径由大到小的顺序为
(4)用电子式表示②、⑤组成化合物的形成过程
(5)④、⑥的最高价氧化物对应水化物相互反应的化学方程式为
(6)由⑤、⑧组成,每个原子均满足最外层8电子稳定结构的化合物的结构式为
(7)下列说法错误的是
a.最简单气态氢化物的稳定性①>⑦>⑧
b.最高价氧化物对应水化物的碱性②>④
c.与⑧号元素同主族的第四周期元素的单质是半导体材料
d.③号元素的单质在氧气中加热可以得到两种氧化物
您最近一年使用:0次
5 . 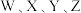 为原子序数依次增大的短周期主族元素,已知
为原子序数依次增大的短周期主族元素,已知 原子最外层电子数是其内层电子数的3倍;
原子最外层电子数是其内层电子数的3倍; 原子半径在短周期主族元素中最大;
原子半径在短周期主族元素中最大; 的单质多出现在火山口附近,且为黄色晶体。下列说法正确的是
的单质多出现在火山口附近,且为黄色晶体。下列说法正确的是
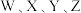 为原子序数依次增大的短周期主族元素,已知
为原子序数依次增大的短周期主族元素,已知 原子最外层电子数是其内层电子数的3倍;
原子最外层电子数是其内层电子数的3倍; 原子半径在短周期主族元素中最大;
原子半径在短周期主族元素中最大; 的单质多出现在火山口附近,且为黄色晶体。下列说法正确的是
的单质多出现在火山口附近,且为黄色晶体。下列说法正确的是A.简单离子半径: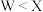 | B. 与 与 可形成共价化合物 可形成共价化合物 |
C.最简单氢化物的沸点: | D.第一电离能; |
您最近一年使用:0次
2023-07-12更新
|
66次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
解题方法
6 . 运用元素周期律分析下面的推断,其中正确的是
| A.铊(Tl)与铝同族,其单质既能与盐酸反应产生氢气,又能与NaOH溶液反应产生氢气 |
B.锂(Li)在氧气中剧烈燃烧,产物是 ,锂溶于水生成一种强碱 ,锂溶于水生成一种强碱 |
| C.砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸 |
D.硒化氢( )是无色、有毒、比 )是无色、有毒、比 稳定的气体 稳定的气体 |
您最近一年使用:0次
解题方法
7 . 已知:A、B、C、D、E是原子序数依次增大的短周期元素,F、G为长周期元素。请根据下列信息回答有关问题。
(1)写出B元素的原子结构示意图:________ ;C、D、E、F的简单离子半径由大到小的顺序为_________ (填离子符号)。
(2)C元素的某氧化物为淡黄色固体,写出该氧化物与水反应的离子方程式:________________ 。
(3)G元素的单质可以在E元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:________________ 。
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为________ 。
(5)A元素与F元素形成的化合物属于___ (填“离子”或“共价”)化合物,该化合物中所含的化学键为___ (填“共价键”或“离子键”)。
| ① | A的单质在所有单质中密度最小 |
| ② | B的一种氧化物可用于人工降雨 |
| ③ | C的一种氧化物可以作供氧制,该氧化物的焰色试验为黄色 |
| ④ | D的氧化物既能与强酸反应,又能与强碱反应生成盐和水 |
| ⑤ | E的一种含氧酸常用作漂白剂和消毒剂,其单质为黄绿色气体 |
| ⑥ | F的焰色试验为紫色(透过蓝色钴玻璃观察) |
| ⑦ | G是用途最广泛的金属,它的一种氧化物可以作磁性材料 |
(2)C元素的某氧化物为淡黄色固体,写出该氧化物与水反应的离子方程式:
(3)G元素的单质可以在E元素的单质中燃烧,其产物的饱和溶液与沸水反应可以得到能产生丁达尔效应的分散系,写出该产物的浓溶液与沸水反应的化学方程式:
(4)C元素的最高价氧化物对应的水化物与E元素的最高价氧化物对应的水化物反应的离子方程式为
(5)A元素与F元素形成的化合物属于
您最近一年使用:0次
名校
8 . 应用元素周期律可预测我们不知道的一些元素及其化合物的性质。下列预测不正确的是
①铍 的氧化物的水化物可能具有两性
的氧化物的水化物可能具有两性
②铊Tl能与盐酸和 溶液反应均产生氢气
溶液反应均产生氢气
③砹At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④ 在氧气中剧烈燃烧,得到的产物中既含有离子键又含有共价键,其溶液是一种强碱
在氧气中剧烈燃烧,得到的产物中既含有离子键又含有共价键,其溶液是一种强碱
⑤硫酸锶SrSO4可能是难溶于水的白色固体
⑥硒化氢H2Se无色,有毒,比H2S稳定
①铍
 的氧化物的水化物可能具有两性
的氧化物的水化物可能具有两性②铊Tl能与盐酸和
 溶液反应均产生氢气
溶液反应均产生氢气③砹At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④
 在氧气中剧烈燃烧,得到的产物中既含有离子键又含有共价键,其溶液是一种强碱
在氧气中剧烈燃烧,得到的产物中既含有离子键又含有共价键,其溶液是一种强碱⑤硫酸锶SrSO4可能是难溶于水的白色固体
⑥硒化氢H2Se无色,有毒,比H2S稳定
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
您最近一年使用:0次
名校
9 . 随着原子序数的递增,A~G七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。

(1)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为_______ 。
(2)用电子式表示元素C与D按原子个数比1∶2形成化合物的过程_______ 。
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是_______ 。
(4)元素A与C形成的电子总数为22的分子的结构式为_______ 。
(5)元素C与D按原子个数比1∶1形成的化合物的电子式为_______ ,其所含的化学键有_______ (填离子键、极性键或非极性键)。
(6)用铂丝蘸取D的氯化物在火焰上灼烧,根据火焰呈现的特征颜色,可以判断D元素的存在,化学上把这种定性分析操作称为_______ 。

(1)在A、B、F、G四种元素中,非金属性最弱的元素在周期表中的位置为
(2)用电子式表示元素C与D按原子个数比1∶2形成化合物的过程
(3)E元素的最高价氧化物与氢氧化钠溶液反应的离子方程式是
(4)元素A与C形成的电子总数为22的分子的结构式为
(5)元素C与D按原子个数比1∶1形成的化合物的电子式为
(6)用铂丝蘸取D的氯化物在火焰上灼烧,根据火焰呈现的特征颜色,可以判断D元素的存在,化学上把这种定性分析操作称为
您最近一年使用:0次
名校
10 . 根据表中部分短周期元素的原子半径及主要化合价信息,下列说法正确的是
| 元素代号 | J | L | M | Q | R | T |
| 原子半径/nm | 0.082 | 0.152 | 0.143 | 0.186 | 0.104 | 0.066 |
| 主要化合价 |  |  |  |  |  、 、 |  |
A.氢化物的沸点为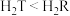 |
B.单质与冷水反应的剧烈程度为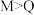 |
C.L单质在T单质中燃烧可生成 |
D.J可形成 ,且与 ,且与 的核外电子排布相同 的核外电子排布相同 |
您最近一年使用:0次
2022-09-02更新
|
243次组卷
|
3卷引用:辽宁省鞍山市普通高中2021-2022学年高一上学期期末质量监测化学试题



