名校
解题方法
1 . 已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,C原子的最内层电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6。请回答下列问题:
(1)元素E在周期表中的位置是_________ ;与元素C同族的下一周期元素的原子结构示意图为_________ 。
(2)M的沸点比PH3的沸点_____ (填“高”或“低”),原因是________ 。
(3)A、C形成的化合物CA与水反应生成无色气体,该反应的化学方程式______ ,每生成l mol气体,转移电子数为______ 。
(4)工业上,将CEO3与Na2SO3溶液混合后,再加入H2SO4制备水消毒剂EO2,该反应的离子方程式______ 。
(5)下列说法正确,且能够证明C的金属性比D强的是____ 。
A C离子的氧化性比D离子的氧化性弱
B C的最高价氧化物水化物的碱性比D的最高价氧化物的水化物碱性强
C C能从D的盐溶液中置换出D
D C在常温下能与水反应,而D不能
(1)元素E在周期表中的位置是
(2)M的沸点比PH3的沸点
(3)A、C形成的化合物CA与水反应生成无色气体,该反应的化学方程式
(4)工业上,将CEO3与Na2SO3溶液混合后,再加入H2SO4制备水消毒剂EO2,该反应的离子方程式
(5)下列说法正确,且能够证明C的金属性比D强的是
A C离子的氧化性比D离子的氧化性弱
B C的最高价氧化物水化物的碱性比D的最高价氧化物的水化物碱性强
C C能从D的盐溶液中置换出D
D C在常温下能与水反应,而D不能
您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)F的离子结构示意图为___________ 。
(2)D、E、F的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出能证明G比F非金属性强的一个化学方程式:_________ 。
(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为___________ , 该反应的化学方程式为___________ 。
(5)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为___________ 。
(1)F的离子结构示意图为
(2)D、E、F的离子半径由大到小的顺序为
(3)写出能证明G比F非金属性强的一个化学方程式:
(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为
(5)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为
您最近一年使用:0次
真题
解题方法
3 . U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______ ;XW的电子式为_______ ;Z元素在周期表中的位置是_______ 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)_______ 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)_______ ;V、W的氢化物分子结合H+能力较强的是(写化学式)_______ ,用一个离子方程式加以证明_______ 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_______ ,由此可知VW和YW2还原性较强的是(写化学式)_______ 。
请回答下列问题:
(1)V的单质分子的结构式为
(2)U元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:
(1)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是___________ 。
(2)分子X的电子式是__________ ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式_________________________________ 。
(3)实验证明,熔融的EF3 不导电,其原因是_______________________ 。
(4)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以E(CA)4- 的形式存在,写出E溶于Z溶液的离子方程式:_____________________ 。
(5)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是_________________ 。
②通电开始后,阴极附近溶液pH___________ (“增大”、“减小”或“不变”)。
③除去杂质后的Z溶液从液体出口_________ (填写“A”或“B”)导出。
(1)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是
(2)分子X的电子式是
(3)实验证明,熔融的EF3 不导电,其原因是
(4)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以E(CA)4- 的形式存在,写出E溶于Z溶液的离子方程式:
(5)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是
②通电开始后,阴极附近溶液pH
③除去杂质后的Z溶液从液体出口
您最近一年使用:0次
5 . I.A〜G七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)A在元素周期表中的位置是_______ ;F的原子结构示意图是_____________ 。
(2)下列事实能证明C和E的非金属性强弱的是_____ 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是______ (填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:_______ 。
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:______ 。已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:_________ 。
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是________ 。写出乙→丙的化学方程式:__________ 。
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:__________ 。室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6mol·L-1,则该溶液的pH为______ 。
(丁的Ksp为1.3×10-33)
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素原子在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物具有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
(1)A在元素周期表中的位置是
(2)下列事实能证明C和E的非金属性强弱的是
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:
(丁的Ksp为1.3×10-33)
您最近一年使用:0次
名校
6 . A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:(用化学用语填空)
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是__________________ 。
(2)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是____________ 。
(3)B、C两种元素的气态氢化物结合质子的能力由大到小的顺序为________ (填化学式),用一个离子方程式证明________________ 。
(4)分子X的电子式是___________ ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式_________________________________ 。
(5)实验证明,熔融的EF3 不导电,其原因是__________________________ 。
(6)E的单质可溶于A、C、D形成的化合物Z的水溶液中,写出该反应的离子方程式:____________________________________________ 。
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是
(2)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是
(3)B、C两种元素的气态氢化物结合质子的能力由大到小的顺序为
(4)分子X的电子式是
(5)实验证明,熔融的EF3 不导电,其原因是
(6)E的单质可溶于A、C、D形成的化合物Z的水溶液中,写出该反应的离子方程式:
您最近一年使用:0次
名校
7 . 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大, W与R同主族,且W的氢化物常温时为液态。X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子。
请用化学用语回答下列问题:
(1)Y、Z、W元素的氢化物沸点由高到低的顺序为____________ (用化学式表示)。
(2)选取上述六种元素中的某些元素组成的化合物中,写出既含极性键又含非极性键,且相对分子质量最小的物质______________ (写电子式)。该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为_______________________________ 。
(3)请用一个化学方程式证明W元素的非金属性强于R元素_________________________________ 。
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的Z4气态分子。Z4分子结构如图所示,已知断裂lmolZ-Z 吸收167kJ的热量,生成lmol Z Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:
Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________ 。
(5)①由X、Z、W三种元素形成的一种离子化合物,其水溶液中离子浓度由大到小的顺序是________________________ 。
②写出检验该化合物中阳离子的实验操作方法是_________________________________________ 。
请用化学用语回答下列问题:
(1)Y、Z、W元素的氢化物沸点由高到低的顺序为
(2)选取上述六种元素中的某些元素组成的化合物中,写出既含极性键又含非极性键,且相对分子质量最小的物质
(3)请用一个化学方程式证明W元素的非金属性强于R元素
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的Z4气态分子。Z4分子结构如图所示,已知断裂lmolZ-Z 吸收167kJ的热量,生成lmol Z
 Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:
Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:
(5)①由X、Z、W三种元素形成的一种离子化合物,其水溶液中离子浓度由大到小的顺序是
②写出检验该化合物中阳离子的实验操作方法是
您最近一年使用:0次
解题方法
8 . X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X 的电子式是__________ 。
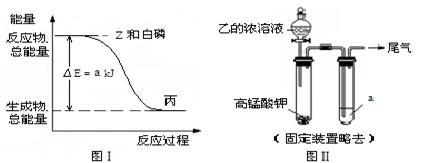
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是__________ 。 白磷固体和 Z 气体反应,生成 1 mol 液态丙时,能量变化如图Ⅰ所示,写出该反应的热化学方程式: _____________________________ 。已知 1 mol 白磷固体和 Z 气体反应,生成固态丁时,放热 b kJ,则 1 mol 固态丁转化为液态丙时的反应热△H =____________________ 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a____ 的水溶液。若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____________________ 。
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是__________ 。
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。

(1)X 的电子式是
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是
您最近一年使用:0次
解题方法
9 . 第三周期元素X、Y、Z的原子序数依次增大,25℃时,0.1mol/L它们最高价氧化物的水化物的溶液,对应的pH分别为13.00、1.57、0.70,下列有关说法正确的是
| A.原子半径:X<Y |
| B.元素电负性:Y<Z |
| C.Y的最高价氧化物的水化物属于强电解质 |
D.Z的最高价氧化物的水化物可能是 |
您最近一年使用:0次
名校
解题方法
10 . 某化合物具漂白性,主要用于染色工艺,其结构如图所示,其中W、X、Y、M、Z是原子序数依次递增的短周期主族元素,且Y和 同主族,下列说法错误的是
同主族,下列说法错误的是
 同主族,下列说法错误的是
同主族,下列说法错误的是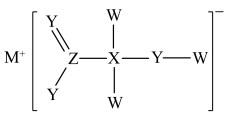
A.电负性: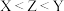 | B. 和 和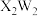 均为极性分子 均为极性分子 |
| C.MW与水反应后的溶液呈碱性 | D. 利 利 的VSEPR模型名称均为平面三角形 的VSEPR模型名称均为平面三角形 |
您最近一年使用:0次
7日内更新
|
299次组卷
|
5卷引用:天津市耀华中学2024届高三下学期第二次模拟化学试题



