1 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,a、b、c、d、e、f是这些元素组成的化合物,其转化关系如图所示,0.01mol/La溶液的pH=12,且焰色反应呈黄色,b是形成酸雨的主要成分,e是二元化合物,且0.01mol/Le溶液的pH=2,下列说法正确的是
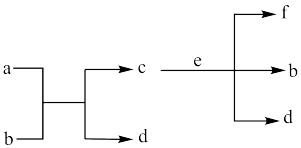
| A.原子半径:Q>W>Z>Y>X | B.简单氢化物的稳定性:Q>W |
| C.a、e、f均能抑制水的电离 | D.a、b、c、d、e、f均含有极性共价键 |
您最近半年使用:0次
2 . A、B、C、D、E是五种原子序数依次递增的短周期元素。已知:A的一种同位素可以用于测定文物的年代;基态C原子含3对成对电子;D在同周期金属元素中第一电离能最大;基态E原子的3p轨道中含有自旋方向不同且数目之比为3:1的电子。下列说法正确的是
| A.简单离子的离子半径:B<C<D<E |
| B.简单氢化物的沸点:A<B<C<E |
| C.D的单质可以在A和C形成的某种化合物中燃烧 |
| D.Xe(氙)是目前最易形成化合物的稀有气体,XeC3为非极性分子 |
您最近半年使用:0次
解题方法
3 . 2024年是元素周期表诞生的第155周年。已知短周期主族元素X、Y、Z、M、N,其原子序数与其对应的0.1mol/L最高价氧化物的水化物溶液,在常温下的pH关系如图所示。下列说法中正确的是

| A.X和Y元素均在p区 | B.元素的电负性:Z>M>N |
| C.M的含氧酸根离子的中心原子为sp2杂化 | D.XN3和ZN3的空间构型均为三角锥形 |
您最近半年使用:0次
名校
4 . 根据所学知识回答下列问题:
(1)化学反应中能量的变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。 和
和 反应生成
反应生成 过程中的能量变化如图所示:
过程中的能量变化如图所示:___________ (填标号)。
A.浓硫酸的稀释 B.二氧化碳与灼热的炭的反应
C.甲烷在氧气中燃烧 D.稀盐酸与碳酸氢钠的反应
②离子半径:
___________ (填“>”或“<”) ,判断的规律为
,判断的规律为___________ 。
③对于反应
 ,每转移0.4
,每转移0.4 电子,此时变化的热量为
电子,此时变化的热量为___________  。
。
(2)短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;常温下,0.01 w溶液中
w溶液中 =1.0×10−10,这几种物质的转化关系如图:
=1.0×10−10,这几种物质的转化关系如图:___________ 个自旋平行的未成对电子。
②基态c原子的简化电子排布式为___________ 。
③过量的z通入w溶液中反应的离子方程式为___________ 。
(3)从能量角度来看, 比
比 的稳定性更
的稳定性更___________ (填“强”或“弱”),从原子结构角度分析其原因:___________ 。
(1)化学反应中能量的变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。
 和
和 反应生成
反应生成 过程中的能量变化如图所示:
过程中的能量变化如图所示: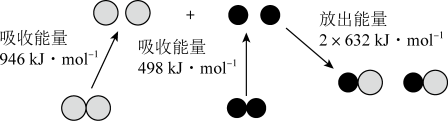
A.浓硫酸的稀释 B.二氧化碳与灼热的炭的反应
C.甲烷在氧气中燃烧 D.稀盐酸与碳酸氢钠的反应
②离子半径:

 ,判断的规律为
,判断的规律为③对于反应

 ,每转移0.4
,每转移0.4 电子,此时变化的热量为
电子,此时变化的热量为 。
。(2)短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;常温下,0.01
 w溶液中
w溶液中 =1.0×10−10,这几种物质的转化关系如图:
=1.0×10−10,这几种物质的转化关系如图: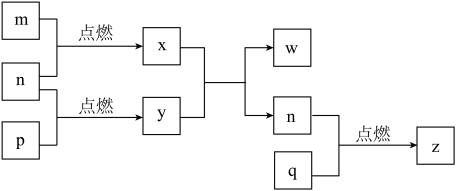
②基态c原子的简化电子排布式为
③过量的z通入w溶液中反应的离子方程式为
(3)从能量角度来看,
 比
比 的稳定性更
的稳定性更
您最近半年使用:0次
名校
5 . 离子液体在电化学研究中应用广泛,某离子液体M由W、X、Y、Z四种原子半径依次增大的短周期元素组成,其结构如图所示。下列说法正确的是
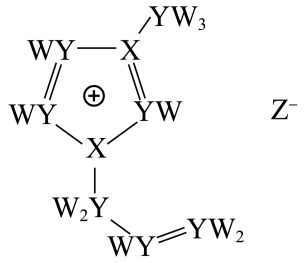

| A.X和Y均能与W形成18电子分子,且前者的沸点相对较高 |
| B.元素Z位于第2周期ⅦA族,属于p区元素 |
| C.物质M的晶体中含有离子键、σ键、π键和氢键 |
| D.若用石墨电极电解M,阴极产生黄绿色气体 |
您最近半年使用:0次
2024-04-09更新
|
129次组卷
|
3卷引用:河北省沧州市泊头市八县联考2023-2024学年高三下学期3月月考化学试题
解题方法
6 . 化合物 可作阻燃剂,其中W、X、Y、Z均为短周期主族元素,Y在地壳中含量最多,X的基态原子价层p轨道半充满,Y只与Z同周期,Y与W的价电子数之和等于Z的价电子数,W为金属元素。下列说法正确的是
可作阻燃剂,其中W、X、Y、Z均为短周期主族元素,Y在地壳中含量最多,X的基态原子价层p轨道半充满,Y只与Z同周期,Y与W的价电子数之和等于Z的价电子数,W为金属元素。下列说法正确的是
 可作阻燃剂,其中W、X、Y、Z均为短周期主族元素,Y在地壳中含量最多,X的基态原子价层p轨道半充满,Y只与Z同周期,Y与W的价电子数之和等于Z的价电子数,W为金属元素。下列说法正确的是
可作阻燃剂,其中W、X、Y、Z均为短周期主族元素,Y在地壳中含量最多,X的基态原子价层p轨道半充满,Y只与Z同周期,Y与W的价电子数之和等于Z的价电子数,W为金属元素。下列说法正确的是A.第一电离能: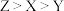 | B.简单氢化物沸点: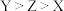 |
C.简单离子半径: | D.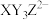 中心原子的价层电子对数为5 中心原子的价层电子对数为5 |
您最近半年使用:0次
名校
7 . 短周期主族元素X、Y、Z、W、M的原子半径依次增大,与元素有关的信息如表所示:
回答下列问题:
(1) 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为___________ ,写出其简单氢化物的一种用途:___________ 。
(2)由 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为___________ 。
(3)上述元素对应的简单离子中半径最大的为___________ (填离子符号)。
(4) 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为___________ 。
(5) 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程___________ 。
(6) 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为___________ 。
(7)下列关于 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。
| 元素 | 相关信息 |
 | 简单氢化物的水溶液可以刻蚀玻璃 |
 | 最外层电子数比次外层多3 |
 | 最高正价和最低负价的代数和为4 |
 | 地壳中含量最高的金属元素 |
 | 最高价氧化物对应水化物属于强碱 |
(1)
 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为(2)由
 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为(3)上述元素对应的简单离子中半径最大的为
(4)
 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为(5)
 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程(6)
 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为(7)下列关于
 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。A.将 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 |
| B.随着原子序数递增,该主族元素对应单质的沸点逐渐升高 |
C.该主族元素中最高价氧化物对应水化物酸性最强的元素为 |
D. 的简单氢化物可与强碱溶液反应 的简单氢化物可与强碱溶液反应 |
您最近半年使用:0次
8 . 甲、乙、丙为原子序数依次增大的不同短周期的主族元素。甲、丙形成的单核离子所带电荷数相同;乙和丙的原子最外层电子数之和为10。下列说法错误的是
| A.丙位于第三周期第ⅦA族 |
| B.甲、丙形成的化合物熔融态不导电 |
| C.最高价含氧酸酸性:乙<丙 |
| D.乙、丙形成的单中心分子中各原子满足8电子结构 |
您最近半年使用:0次
9 . 回答下列问题
(1)有A、B、C、D、E五种元素,它们的核电荷数依次增大,A是元素周期表中原子半径最小的一种元素,B、C、D、E是连继相邻的四种元素,且均比A多一个电子层,其中E是元素周期表中非金属性最强的一种元素,按要求完成下列问题:
①这几种元素中电负性最大的是_______ (填元素符号,下同);
②B、C、D、E的第一电离能由小到大的顺序是_______ ;
③C的最高价氧化物对应的水化物和C的最低价氢物形成的化合物的化学式是_______ 。
(2)太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:
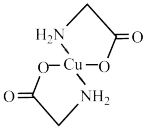
①硅原子电子占据的最高能级电子云形状为_______ ;
②Fe3+的价电子排布图为_______ ;
③铜位于周期表中_______ 区,铜原子的电子排布式为_______ 。试从核外电子排布角度比较,高温下Cu2O和CuO的稳定性更高的原因是_______ 。
(1)有A、B、C、D、E五种元素,它们的核电荷数依次增大,A是元素周期表中原子半径最小的一种元素,B、C、D、E是连继相邻的四种元素,且均比A多一个电子层,其中E是元素周期表中非金属性最强的一种元素,按要求完成下列问题:
①这几种元素中电负性最大的是
②B、C、D、E的第一电离能由小到大的顺序是
③C的最高价氧化物对应的水化物和C的最低价氢物形成的化合物的化学式是
(2)太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:

①硅原子电子占据的最高能级电子云形状为
②Fe3+的价电子排布图为
③铜位于周期表中
您最近半年使用:0次
10 . X、Y、Z、W均为短周期主族元素,X和Z同主族,Y和W同主族,其中X的核外成对电子数是未成对电子数的两倍,Y是电负性最强的元素,其单质在常温下可与水发生置换反应生成一种无色无味的气体和一种弱酸,下列说法中错误的是
| A.X构成的物质种类最多 |
| B.Z的单质可用于制造光导纤维 |
| C.W元素的简单离子对水的电离平衡无影响 |
| D.原子半径大小关系:Z>W>X>Y |
您最近半年使用:0次



