解题方法
1 . 通常状况下, 、
、 和
和 是三种气态单质。
是三种气态单质。 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外); 和
和 均由元素
均由元素 组成,
组成, 能氧化
能氧化 ,反应的离子方程式为
,反应的离子方程式为 。
。
(1)写出物质的分子式:
______ ,
______ ,
______ 。
(2) 与
与 的关系是
的关系是______ (填序号)。
a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中 减少的主要物质是
减少的主要物质是______ 。
(4)将 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________ 。
(5)举例说明 的氧化性比硫单质的氧化性强:
的氧化性比硫单质的氧化性强:________________________ (用化学方程式表示)。
 、
、 和
和 是三种气态单质。
是三种气态单质。 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外); 和
和 均由元素
均由元素 组成,
组成, 能氧化
能氧化 ,反应的离子方程式为
,反应的离子方程式为 。
。(1)写出物质的分子式:



(2)
 与
与 的关系是
的关系是a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中
 减少的主要物质是
减少的主要物质是(4)将
 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是(5)举例说明
 的氧化性比硫单质的氧化性强:
的氧化性比硫单质的氧化性强:
您最近一年使用:0次
2020-03-02更新
|
220次组卷
|
2卷引用:专题1微观结构与物质的多样性易错疑难集训(二)
2020高三·全国·专题练习
2 . 短周期元素X、Y、Z、W的原子序数依次增大,X的原子在周期表中半径最小,Y的次外层电子数是其最外层的 ,Z单质可与冷水缓慢反应产生X单质,W与Y属于同一主族。下列叙述正确的是
,Z单质可与冷水缓慢反应产生X单质,W与Y属于同一主族。下列叙述正确的是
 ,Z单质可与冷水缓慢反应产生X单质,W与Y属于同一主族。下列叙述正确的是
,Z单质可与冷水缓慢反应产生X单质,W与Y属于同一主族。下列叙述正确的是| A.由Y元素形成的离子与Z元素形成的离子的核外电子总数可能相同 |
| B.单质的氧化性:W>Y |
| C.化合物X2Y、ZY、ZX2中化学键的类型均相同 |
| D.原子半径:rW>rZ>rY |
您最近一年使用:0次
名校
3 . X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的 。下列说法正确的是( )。
。下列说法正确的是( )。
 。下列说法正确的是( )。
。下列说法正确的是( )。| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为共价化合物 |
| C.M2Z2有强氧化性,分子中只有共价键 |
| D.由X、Y、Z、M四种元素形成的化合物可能既有离子键,又有共价键 |
您最近一年使用:0次
名校
解题方法
4 . 现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为________ 、E是________ (填元素名称)。
(2)D的单质分子的结构式_______ ,C元素最高价氧化物的水化物的电子式____ 。
(3)写出工业上冶炼B单质的化学方程式_______________ 。
(4)写出CD的溶液中通入氯气的离子方程式________________ 。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性_________ 。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为
(2)D的单质分子的结构式
(3)写出工业上冶炼B单质的化学方程式
(4)写出CD的溶液中通入氯气的离子方程式
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性
您最近一年使用:0次
2020-05-19更新
|
129次组卷
|
3卷引用:江苏省南通市海安高级中学2019-2020学年高一下学期5月月考化学试题
16-17高三上·江西南昌·期末
解题方法
5 . W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻,Y与Z相邻。已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X,Y位于同一族,它们能组成YX2,YX3两种常见化合物。请回答下列问题:
(1)X元素位于周期表的位置为_______________ 。
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是________ (填化学式)。
(3)a溶液的pH____ 7(填“>”、“<”或“=”),用离子方程式解释为:___________ 。
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为______ 。Y2Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为_________ 。
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:4WH3(g)+5O2(g)=4WO(g)+6H2O(g)∆H=-905.8kJ/mol;已知W2(g)+O2(g)=2WO(g)∆H=+180kJ/mol,则WH3与氧气反应产生两种无污染物质的热化学方程式为__________________ 。
(1)X元素位于周期表的位置为
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是
(3)a溶液的pH
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:4WH3(g)+5O2(g)=4WO(g)+6H2O(g)∆H=-905.8kJ/mol;已知W2(g)+O2(g)=2WO(g)∆H=+180kJ/mol,则WH3与氧气反应产生两种无污染物质的热化学方程式为
您最近一年使用:0次
6 . 现有部分短周期元素的性质或原子结构如表:
 用化学用语回答下列问题:
用化学用语回答下列问题:
 元素在周期表中的位置
元素在周期表中的位置 ______ ;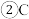 单质分子的电子式
单质分子的电子式 ______ ;
 的原子结构示意图
的原子结构示意图 ______ ; 电子式表示A和B元素组成的化合物的形成过程:
电子式表示A和B元素组成的化合物的形成过程: ______ .
 元素D与元素A相比,非金属性较强的是
元素D与元素A相比,非金属性较强的是 ______  用元素符号表示
用元素符号表示 ,下列表述中能证明这一事实的是
,下列表述中能证明这一事实的是 ______  填选项序号
填选项序号 .
.
 常温下D的单质和A的单质状态不同
常温下D的单质和A的单质状态不同
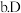 的氢化物比A的氢化物稳定
的氢化物比A的氢化物稳定
 一定条件下D和A的单质都能与钠反应
一定条件下D和A的单质都能与钠反应
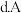 最高价含氧酸的酸性弱于D最高价含氧酸
最高价含氧酸的酸性弱于D最高价含氧酸
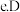 单质能与A的氢化物反应生成A单质
单质能与A的氢化物反应生成A单质
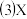 是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为
是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为 其他条件略去
其他条件略去 .
.
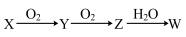
 若Y是有刺激性气味的无色气体,把Y通入
若Y是有刺激性气味的无色气体,把Y通入 溶液中,无现象,然后滴加适量
溶液中,无现象,然后滴加适量 溶液,有白色沉淀生成,则该白色沉淀为
溶液,有白色沉淀生成,则该白色沉淀为 ______ ,试写出Y与 溶液反应的化学方程式:
溶液反应的化学方程式: ______ ;
 若Z是红棕色气体,则
若Z是红棕色气体,则 的反应中氧化剂与还原剂物质的量之比为
的反应中氧化剂与还原剂物质的量之比为 ______ .
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是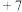 价 价 |
 用化学用语回答下列问题:
用化学用语回答下列问题:  元素在周期表中的位置
元素在周期表中的位置 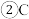 单质分子的电子式
单质分子的电子式  的原子结构示意图
的原子结构示意图  电子式表示A和B元素组成的化合物的形成过程:
电子式表示A和B元素组成的化合物的形成过程:  元素D与元素A相比,非金属性较强的是
元素D与元素A相比,非金属性较强的是  用元素符号表示
用元素符号表示 ,下列表述中能证明这一事实的是
,下列表述中能证明这一事实的是  填选项序号
填选项序号 .
. 常温下D的单质和A的单质状态不同
常温下D的单质和A的单质状态不同 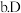 的氢化物比A的氢化物稳定
的氢化物比A的氢化物稳定  一定条件下D和A的单质都能与钠反应
一定条件下D和A的单质都能与钠反应 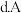 最高价含氧酸的酸性弱于D最高价含氧酸
最高价含氧酸的酸性弱于D最高价含氧酸 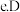 单质能与A的氢化物反应生成A单质
单质能与A的氢化物反应生成A单质 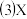 是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为
是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为 其他条件略去
其他条件略去 .
.
 若Y是有刺激性气味的无色气体,把Y通入
若Y是有刺激性气味的无色气体,把Y通入 溶液中,无现象,然后滴加适量
溶液中,无现象,然后滴加适量 溶液,有白色沉淀生成,则该白色沉淀为
溶液,有白色沉淀生成,则该白色沉淀为  溶液反应的化学方程式:
溶液反应的化学方程式:  若Z是红棕色气体,则
若Z是红棕色气体,则 的反应中氧化剂与还原剂物质的量之比为
的反应中氧化剂与还原剂物质的量之比为
您最近一年使用:0次
7 . 短周期元素A、B、C、D、E在元素周期表中的相对位置如表所示,其中E的单质在标况下是一种气体,下列说法中正确的是( )
| A | C | ||
| B | D | E |
| A.原子半径大小:C>A |
| B.E单质具有较强氧化性,参加反应时,只作氧化剂 |
| C. B与C形成的化合物是常见的半导体材料 |
| D.C与D可以形成两种常见的化合物 |
您最近一年使用:0次
名校
8 . 有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )
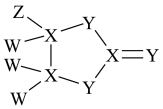

| A.WZ沸点高于W2Y的沸点 |
| B.含Z的两种酸反应可制得Z的单质 |
| C.W2Y2中既含离子键又含共价键键 |
| D.X的含氧酸一定为二元弱酸 |
您最近一年使用:0次
2020-03-15更新
|
355次组卷
|
6卷引用:浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题
浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题湖南师范大学附属中学2020届高三第五次月考化学试题新疆维吾尔自治区乌鲁木齐市第一中学 2020 届高三第一次理科综合能力测试化学试题(已下线)考点05 元素周期表和元素周期律-2020年高考化学命题预测与模拟试题分类精编浙江省丽水市高中发展共同体2020-2021学年高二下学期期中联合测试化学试题2024届天津市十二区县重点学校高三第一次调研测试化学试卷含解析
名校
解题方法
9 . 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8。常见元素Z的单质是目前使用量最大的主族金属元素单质,下列说法中不正确的是
| A.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
| B.沸点:YX3>XW |
| C.化合物YW3遇水能强烈水解,产物之一具有强氧化性 |
| D.离子化合物YX5假如存在。该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
您最近一年使用:0次
2020-02-24更新
|
105次组卷
|
2卷引用:江西临川二中2019届高三第二次模拟考试化学试卷
名校
10 . 如表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
(1)Z的元素符号是________ ,原子结构示意图是_________ 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为_________ 。
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
| W | X | Y |
| Z |
(1)Z的元素符号是
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
| 1 | ||
| 2 |
您最近一年使用:0次



