1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
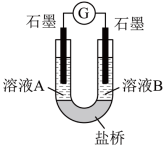
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
346次组卷
|
4卷引用:北京市门头沟区2020届高三3月综合练习化学试题
北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
名校
2 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。
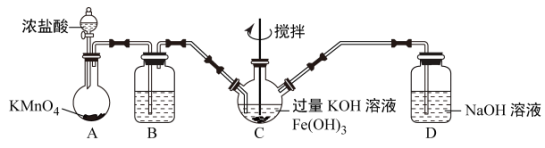
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近一年使用:0次
2021-09-17更新
|
323次组卷
|
2卷引用:江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷
3 . 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
①能否各取少许固体用舌头品尝?____________ 。
②用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有_________ 性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下
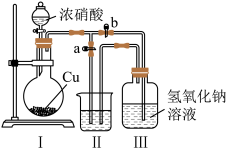
已知:2NO2+2NaOH=NaNO2+NaNO3+H2 O
①写出装置I中发生反应的化学方程式____________________________ 。
②水_____________ (选填“能"或“不能”)作为装置Ⅱ中的试剂,理由是_____________ 。
③装置Ⅲ中反应完全后,接下来的操作是____________________________ 。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_____ (选填“增多”、“减少"或“不变”),原因可能是____________________________ (用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从1000g刚煮熟的肉和1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗16.00mL,(已知:2MnO +5 NO
+5 NO +6H+=2 Mn2++5NO
+6H+=2 Mn2++5NO +3 H2 O)
+3 H2 O)
①滴定终点的判断依据为_______________________________ 。
②隔夜熟肉中NaNO2的含量是____________ mg/kg。
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
①能否各取少许固体用舌头品尝?
②用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下

已知:2NO2+2NaOH=NaNO2+NaNO3+H2 O
①写出装置I中发生反应的化学方程式
②水
③装置Ⅲ中反应完全后,接下来的操作是
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量
活动四:检测熟肉中NaNO2含量的变化
(4)分别从1000g刚煮熟的肉和1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗16.00mL,(已知:2MnO
 +5 NO
+5 NO +6H+=2 Mn2++5NO
+6H+=2 Mn2++5NO +3 H2 O)
+3 H2 O)①滴定终点的判断依据为
②隔夜熟肉中NaNO2的含量是
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
您最近一年使用:0次
4 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
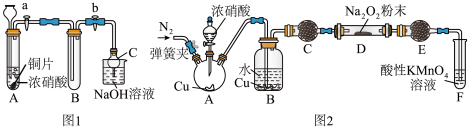
(1)甲同学设计如图1装置进行实验:
①试管A 中反应的离子方程式是____________________________ 。
②待试管B 中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________ 。
结论:甲同学认为假设2 正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________ 。
Ⅱ.该研究性学习小组同学还认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________ 。
②B 中观察到的主要现象是____________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
③C、E 中所盛装的试剂不能是________ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F 中发生反应的氧化剂与还原剂的物质的量之比为_____________ 。
⑤充分反应后,检验D装置中产物的方法是:______________ ,则产物是NaNO2。

Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A 中反应的离子方程式是
②待试管B 中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2 正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO
 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B 中观察到的主要现象是
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
③C、E 中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F 中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:
您最近一年使用:0次
名校
5 . 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___ 。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
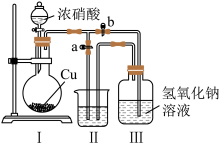
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________ (用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2 O)
①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____ mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________

| A.NaCl | B.H2O | C.H2SO4 | D.NaOH |
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2 O)
①滴定终点的判断依据为
②隔夜熟肉中NaNO2的含量是
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
您最近一年使用:0次
2017-04-19更新
|
146次组卷
|
2卷引用:2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷
6 . 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料:NaNO2有毒,溶液显碱性,NaNO2有较强的氧化性和较弱的还原性。国家规定肉制品中NaNO2含量不能超过30 mg/kg。
(1)NaNO2溶液显碱性的原因是_____________________ 。(用离子方程式表达)
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是_________ 。(填化学式)。
活动三:检测熟肉中NaNO2含量的变化
(3)分别从 1000 g刚煮熟的肉和 1000 g隔夜熟肉中提取NaNO2,配成溶液,再分别用0.00500 mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00 mL,隔夜熟肉消耗16.00 mL。(提示:MnO4一转化为Mn2+,NO2一转化为NO3一)
① 在做该滴定实验时需要用到的实验仪器有___________
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
② 滴定终点的判断依据为_________________ 。
③ 隔夜熟肉中NaNO2的含量是____________ mg/kg (保留三位有效数字),该数据说明保存得当的隔夜熟肉_________ (选填“能”或“不能” )食用。
活动一:查阅资料:NaNO2有毒,溶液显碱性,NaNO2有较强的氧化性和较弱的还原性。国家规定肉制品中NaNO2含量不能超过30 mg/kg。
(1)NaNO2溶液显碱性的原因是
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是
活动三:检测熟肉中NaNO2含量的变化
(3)分别从 1000 g刚煮熟的肉和 1000 g隔夜熟肉中提取NaNO2,配成溶液,再分别用0.00500 mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00 mL,隔夜熟肉消耗16.00 mL。(提示:MnO4一转化为Mn2+,NO2一转化为NO3一)
① 在做该滴定实验时需要用到的实验仪器有
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
② 滴定终点的判断依据为
③ 隔夜熟肉中NaNO2的含量是
您最近一年使用:0次
解题方法
7 . 某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为____________________ 。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有_______ (填:“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:__ MnO +
+__ H2C2O4+__ H+=__ Mn2++__ CO2↑+__ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是____________________ 。乙二酸分解的化学方程式为________________ 。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________ 。
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:__________________ 。
(6)设计实验证明草酸的酸性比碳酸强:__________________ 。
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有
 +
+(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:
(6)设计实验证明草酸的酸性比碳酸强:
您最近一年使用:0次
解题方法
8 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
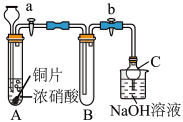
①试管A中反应的离子方程式是___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________ 。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________ 。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________ 。
②B中观察到的主要现象的是_________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________ 。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________ ,则产物是NaNO2。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:

①试管A中反应的离子方程式是
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
您最近一年使用:0次
名校
9 . 碘酸钾(KIO3)是重要的食品添加剂,某化学兴趣小组查阅资料得知,HIO3与KIO3均为白色固体,能溶于水,难溶于部分有机溶剂,且KIO3在碱性条件下易被ClO 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
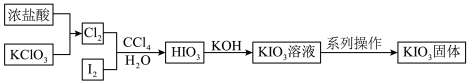
 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
| A.浓盐酸在反应中体现了氧化性 |
| B.加入CCl4目的是萃取I2 |
| C.加入KOH前,应先对原溶液加热煮沸 |
| D.系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥 |
您最近一年使用:0次
2020-11-26更新
|
622次组卷
|
2卷引用:江苏省启东市2021届高三上学期期中考试化学试题
10 . 某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
【查阅资料】
【实验探究】
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:
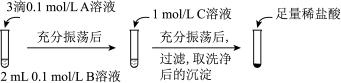
(1)实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入稀盐酸后,__________ 。
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_________ 。
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:___________ 。
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。
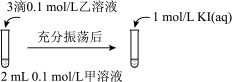
甲溶液可以是______ (填字母代号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率__________ (填“大于”或“小于”)沉淀反应速率。设计(-)石墨(s)[I-(aq)//Ag+(aq)]石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)如上图所示,则该原电池总反应的离子方程式为________ 。
②结合信息,解释实验Ⅳ中b<a的原因:__________ 。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_________ 。
【实验结论】溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
【查阅资料】
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
| 溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | ||||
| 实验Ⅱ | BaCl2 | |||
| Na2CO3 | Na2SO4 | …… | ||
| Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。

甲溶液可以是
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表读数 |
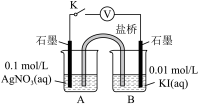 | ||
| ⅰ.按图连接装置并加入试剂,闭合K | a | |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率
②结合信息,解释实验Ⅳ中b<a的原因:
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是
【实验结论】溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
您最近一年使用:0次



