名校
解题方法
1 . 某同学欲探究 的氧化还原性:
的氧化还原性:
资料: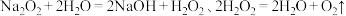
制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。
检验 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。
I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
(2)猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有___________ 性,能与 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是 。
。
综上所述, 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
 的氧化还原性:
的氧化还原性:资料:
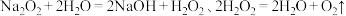
制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。检验
 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:(2)猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i |  | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是
 。
。综上所述,
 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
您最近一年使用:0次
2 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是___________ 。
(2)探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是
(2)探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 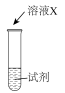 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
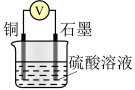
3 . 已知Cu与 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)硫酸溶液的配制
①配制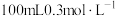 的
的 溶液,需要
溶液,需要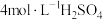 溶液的体积为
溶液的体积为___________ mL(计算结果保留一位小数)。
②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是___________ (填仪器名称)。
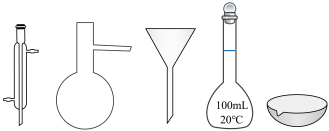
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
已知:本实验条件下, 对电压的影响可忽略。
对电压的影响可忽略。
①根据表中信息,补充数据:
___________ 。
②由实验2和4可知,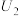
___________ 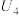 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。
(3)由(2)中实验结果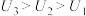 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下, 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
②该实验装置中盐桥的作用为___________ 。
③若实验结果为: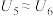 、
、___________ ,说明猜想2不成立,猜想1成立。
(4)已知Cu与 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:___________ 。
(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为___________ 。
 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:I.实验准备
(1)硫酸溶液的配制
①配制
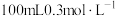 的
的 溶液,需要
溶液,需要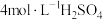 溶液的体积为
溶液的体积为②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是

II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
| 实验装置 | 实验序号 | 烧杯中所加的试剂 | 电压表的读数 | ||
 | 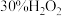 |  硫酸溶液 硫酸溶液 |  | ||
| V/mL | V/mL | V/mL | |||
| 1 | 30.0 | / | 10.0 | 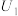 | |
| 2 | 30.0 | 1.0 | 9.0 | 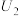 | |
| 3 | 30.0 | 2.0 | 8.0 |  | |
| 4 | 30.0 | 1.0 |  | 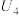 | |
 对电压的影响可忽略。
对电压的影响可忽略。①根据表中信息,补充数据:

②由实验2和4可知,
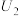
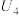 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。(3)由(2)中实验结果
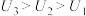 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,
 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
| 实验装置 | 实验序号 | 实验操作 | 电压表的读数 |
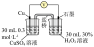 | 5 | / | 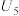 |
| 6 | 向①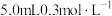 硫酸溶液 硫酸溶液 | 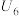 | |
| 7 | 向另一侧烧杯中滴加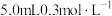 硫酸溶液 硫酸溶液 | 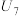 |
③若实验结果为:
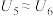 、
、(4)已知Cu与
 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为
您最近一年使用:0次
名校
解题方法
4 . 某同学设计了如下装置用于制取SO2和验证SO2的性质。
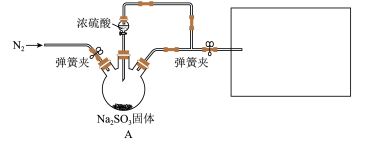
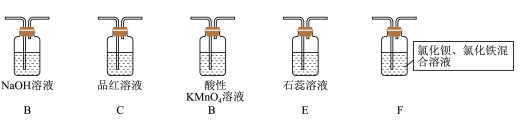
已知:Fe3+具有一定氧化性。
(1)装置 中发生反应的化学方程式为
中发生反应的化学方程式为_______ 。
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
_______ (填装置字母,还原性设计两个装置)。
(3)实验前必须鼓入N2,目的是_______ 。
(4)装置F中产生了白色沉淀,其成分是_______ (化学式),分析F中产生白色沉淀原因_______ 。
(5)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g样品,配成100mL溶液;取其中的25.00mL溶液,与0.2000mol/L酸性KMnO4溶液发生以下反应:2MnO +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为
+3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为_______ (保留三位有效数字)。
(6)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示:
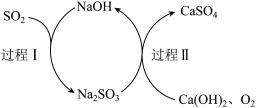
写出过程I的离子反应方程式_______ 。


已知:Fe3+具有一定氧化性。
(1)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
(3)实验前必须鼓入N2,目的是
(4)装置F中产生了白色沉淀,其成分是
(5)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g样品,配成100mL溶液;取其中的25.00mL溶液,与0.2000mol/L酸性KMnO4溶液发生以下反应:2MnO
 +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为
+3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为(6)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示:

写出过程I的离子反应方程式
您最近一年使用:0次
名校
解题方法
5 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为_____ (填序号)。
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有_____ 、_____ 。
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是_____ 。
a.Fe3+、Br- b.Fe3+、S2- c.NO 、H+、I- d.H+、MnO
、H+、I- d.H+、MnO 、I-
、I-
(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为_____ 。(已知MnO 在酸性环境下的产物为Mn2+)
在酸性环境下的产物为Mn2+)
(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
①猜想1为______ ,实验1所用试剂a为______ ,实验1的现象为______ 。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为______ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 | H2O2 | H2O2(酸化) | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | NaBr | KI | Na2S |
| 浓度 | 5% | 5% | 0.1mol•L-1 | |||||
| 电位值/mV | 276 | 683 | 671 | 1130 | 603 | 362 | 116 | -361 |
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是
a.Fe3+、Br- b.Fe3+、S2- c.NO
 、H+、I- d.H+、MnO
、H+、I- d.H+、MnO 、I-
、I-(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为
 在酸性环境下的产物为Mn2+)
在酸性环境下的产物为Mn2+)(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
| 序号 | 实验操作 | 试剂 | 现象 | 结论 |
| 1 | 分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象 | a | ______ | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确(I2被氧化为IO ) ) | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为
您最近一年使用:0次
2023-01-11更新
|
388次组卷
|
3卷引用:广东省佛山市2022-2023学年高一上学期普通高中教学质量检测化学试题
6 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
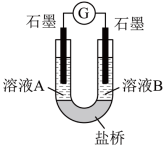
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
346次组卷
|
4卷引用:江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
江苏省昆山中学2022-2023学年高一下学期期中考试化学试题北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究
7 . 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。

I.上图是元素周期表的一部分,回答下列问题:
(1)元素②位于元素周期表的第_______ 周期_______ 族,它的一种质量数为14的原子可测定文物年代,用核素符号表示该原子是_______ 。
(2)元素⑥的原子结构示意图是_______ 。
(3)上述①~⑥号元素的最高价氧化物对应的水化物 中,酸性最强的是_______ ,碱性最强的是_______ (填化学式)。
II.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(4)实验①中反应的离子方程式是_______ 。
(5)实验②观察到的现象是_______ ,甲同学根据此现象得出结论:氧化性Br2>I2。乙同学认为实验②不能充分证明氧化性Br2>I2,其理由是_______ 。
(6)从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下_______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

I.上图是元素周期表的一部分,回答下列问题:
(1)元素②位于元素周期表的第
(2)元素⑥的原子结构示意图是
(3)上述①~⑥号元素的最高价氧化物对应的
II.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 | 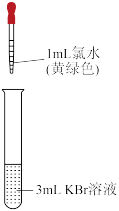 |  |
| 现象 | 溶液变为黄色 |
(5)实验②观察到的现象是
(6)从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下
您最近一年使用:0次
名校
8 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的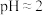 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的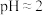 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1051次组卷
|
7卷引用:热点1实验方案设计
热点1实验方案设计四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学
名校
解题方法
9 . 铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。铁及其化合物在日常生产生活中有着广泛应用。
Ⅰ.铁是人体必需的微量元素之一,当人体贫血时,可以服用含 的补血剂,补铁剂中的
的补血剂,补铁剂中的 在空气中很容易被氧化为
在空气中很容易被氧化为 ,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
[实验操作]第一步:在A、B两支试管中加入对比试剂;
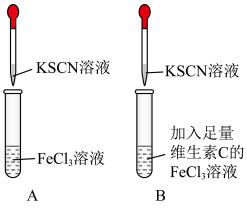
第二步:振荡;
第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变___________ 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有___________ (填“氧化性”或“还原性”),能防止 被氧化为
被氧化为 ,所以补铁剂和维生素C一起服用具有科学依据。
,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和 ,放入水中立即产生大量气泡(
,放入水中立即产生大量气泡( )使口感更好,说明维生素C具有
)使口感更好,说明维生素C具有___________ (填“酸性”或“碱性”)。
(4)由以上信息可知,为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意___________ (写一条即可)。
Ⅱ.在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,原因是:在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知: 中Fe的化合价为
中Fe的化合价为 价、
价、 价)。
价)。
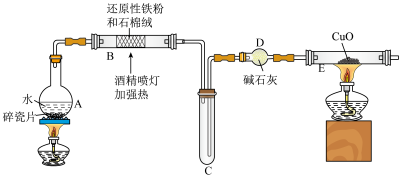
(5)装置B中发生反应的化学方程式为___________ 。
(6)装置C中导管“短进长出”的原因___________ 。
(7)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液若没有出现红色,原因是___________ (用离子方程式表示)。
Ⅰ.铁是人体必需的微量元素之一,当人体贫血时,可以服用含
 的补血剂,补铁剂中的
的补血剂,补铁剂中的 在空气中很容易被氧化为
在空气中很容易被氧化为 ,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。[实验操作]第一步:在A、B两支试管中加入对比试剂;

第二步:振荡;
第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变
[实验结论]
(2)维生素C具有
 被氧化为
被氧化为 ,所以补铁剂和维生素C一起服用具有科学依据。
,所以补铁剂和维生素C一起服用具有科学依据。[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和
 ,放入水中立即产生大量气泡(
,放入水中立即产生大量气泡( )使口感更好,说明维生素C具有
)使口感更好,说明维生素C具有(4)由以上信息可知,为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意
Ⅱ.在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,原因是:在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:
 中Fe的化合价为
中Fe的化合价为 价、
价、 价)。
价)。
(5)装置B中发生反应的化学方程式为
(6)装置C中导管“短进长出”的原因
(7)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液若没有出现红色,原因是
您最近一年使用:0次
解题方法
10 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次



