解题方法
1 . 人体必需的一些元素在周期表中的分布情况如下:
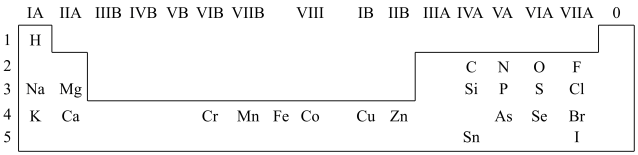
(1)请在上图中画出金属与非金属的分界线______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是______ (填字母)。
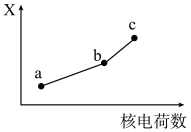
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。
(6)某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验②观察到的现象是______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是______ 。试从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下,______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl | H₂O | CO₂ | CH₄ |
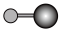 | 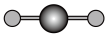 | 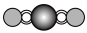 | 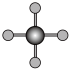 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅥA族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
(6)某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 |  |  |
| 现象 | 溶液变为黄色 |
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
名校
解题方法
2 . 某同学欲探究 的氧化还原性:
的氧化还原性:
资料:
制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。
检验 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。
I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
(2)猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有___________ 性,能与 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是 。
。
综上所述, 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
 的氧化还原性:
的氧化还原性:资料:
制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。检验
 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:(2)猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i |  | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是
 。
。综上所述,
 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
您最近一年使用:0次
名校
解题方法
3 . 某实验小组探究用银氨溶液检验醛基适宜的条件。
资料:i. 、
、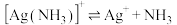
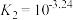 。
。
ii. 不稳定,极易分解为黑色
不稳定,极易分解为黑色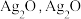 溶于氨水。
溶于氨水。
(1)实验发现:乙醛和 溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时, 和氨水生成
和氨水生成 ,写出生成
,写出生成 的化学方程式
的化学方程式___________ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是 、
、___________ 。
(2)甲同学查阅资料:银镜反应时, 被还原成
被还原成 。
。
①电极反应式:
i.还原反应: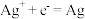
ii.氧化反应:___________ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
i.随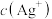 降低,
降低, 氧化性减弱。
氧化性减弱。
ii.随 增大,乙醛还原性增强。
增大,乙醛还原性增强。
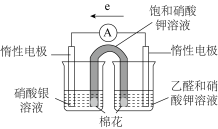
③补充实验验证②中的分析。实验操作及现象:
实验I:插入“饱和 溶液”盐桥,电流表指针偏转;
溶液”盐桥,电流表指针偏转;
实验II:电流稳定后向右侧烧杯滴加 溶液,指针偏转幅度增大;
溶液,指针偏转幅度增大;
实验III:电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小
乙同学认为实验III不能证明“随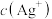 降低,
降低, 氧化性减弱”,理由是
氧化性减弱”,理由是___________ 。
(3)设计实验进一步验证。
①乙同学认为通过实验IV能证明“随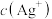 降低,
降低, 氧化性减弱”,你认为是否合理并说明原因
氧化性减弱”,你认为是否合理并说明原因___________ 。
②分析实验V中“立即出现银镜的原因”,提出假设:随 增大,可能是
增大,可能是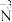 也参与了还原
也参与了还原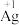 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是___________ 。
(4)综上所述,银氨溶液检验醛基时,做氧化剂的粒子是___________ ;为观察到银镜的生成,银氨溶液中加入较浓的 溶液,该方案是否合理,说明理由:
溶液,该方案是否合理,说明理由:___________ 。
资料:i.
 、
、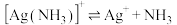
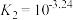 。
。ii.
 不稳定,极易分解为黑色
不稳定,极易分解为黑色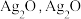 溶于氨水。
溶于氨水。
(1)实验发现:乙醛和
 溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。①有研究表明:配制银氨溶液时,
 和氨水生成
和氨水生成 ,写出生成
,写出生成 的化学方程式
的化学方程式②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是
 、
、(2)甲同学查阅资料:银镜反应时,
 被还原成
被还原成 。
。①电极反应式:
i.还原反应:
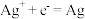
ii.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
i.随
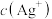 降低,
降低, 氧化性减弱。
氧化性减弱。 ii.随
 增大,乙醛还原性增强。
增大,乙醛还原性增强。③补充实验验证②中的分析。实验操作及现象:
实验I:插入“饱和
 溶液”盐桥,电流表指针偏转;
溶液”盐桥,电流表指针偏转;实验II:电流稳定后向右侧烧杯滴加
 溶液,指针偏转幅度增大;
溶液,指针偏转幅度增大;实验III:电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小
乙同学认为实验III不能证明“随
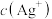 降低,
降低, 氧化性减弱”,理由是
氧化性减弱”,理由是(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| IV | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| V | 往盛有银氨溶液的试管中滴加较浓的 溶液至 溶液至 与实验IV相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 与实验IV相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
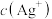 降低,
降低, 氧化性减弱”,你认为是否合理并说明原因
氧化性减弱”,你认为是否合理并说明原因②分析实验V中“立即出现银镜的原因”,提出假设:随
 增大,可能是
增大,可能是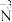 也参与了还原
也参与了还原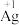 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)综上所述,银氨溶液检验醛基时,做氧化剂的粒子是
 溶液,该方案是否合理,说明理由:
溶液,该方案是否合理,说明理由:
您最近一年使用:0次
4 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是___________ 。
(2)探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,其原因是
(2)探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液 ②FeSO4溶液 ③Cl2④HNO3溶液
任选一个你所选的物质进行实验,观察到
(3)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 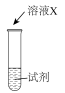 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
5 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
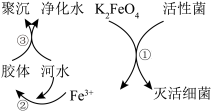
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
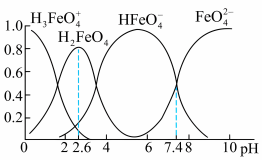
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
名校
解题方法
6 . 某学习小组将Cu与H2O2的反应设计为原电池,并进行相关实验探究。回答下列问题:
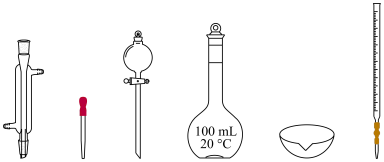
(1)稀硫酸的配制
①配制100 mL 0.3 mol/L的H2SO4溶液,需18 mol/LH2SO4溶液的体积为___________ mL(保留2位小数)。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是___________ (填仪器名称)。
(2)实验探究
【实验目的】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【实验设计】利用下表所示装置进行实验1~4,记录数据。
(已知:本实验条件下, 对电压的影响可忽略。)
对电压的影响可忽略。)
①Cu与H2O2在酸性条件下反应的离子方程式为___________ 。
②根据表中信息,补充数据:V1=___________ 。
③由实验2和4可知,U2___________ U4 (填“<”或“>”或“=”),说明其他条件相同时,H2O2溶液的浓度越大,其氧化性越强。
(3)由(2)中实验结果U3>U2>U1,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下,H2O2的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(2)中实验1~4的基础上,利用下表装置分别进行实验5~8,并记录数据。
①U7>U5、U5≈ U6说明猜想1成立,猜想2不成立。实验7的操作是___________ 。
②实验8左侧烧杯中加入5 mL浓氨水(过量)时可观察到的实验现象是___________ 。U8>U5,其原因可能是___________ 。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
(1)稀硫酸的配制
①配制100 mL 0.3 mol/L的H2SO4溶液,需18 mol/LH2SO4溶液的体积为
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是

(2)实验探究
【实验目的】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【实验设计】利用下表所示装置进行实验1~4,记录数据。
(已知:本实验条件下,
 对电压的影响可忽略。)
对电压的影响可忽略。)| 装置 | 实验序号 | 烧杯中所加试剂 | 电压表读数 | ||
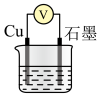 | 30% H2O2 | 0.3 mol/LH2SO4 | H2O | ||
| V/mL | V/mL | V/mL | |||
| 1 | 30.0 | 0 | 10.0 | U1 | |
| 2 | 30.0 | 1.0 | 9.0 | U2 | |
| 3 | 30.0 | 2.0 | 8.0 | U3 | |
| 4 | 35.0 | 1.0 | V1 | U4 | |
②根据表中信息,补充数据:V1=
③由实验2和4可知,U2
(3)由(2)中实验结果U3>U2>U1,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下,H2O2的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(2)中实验1~4的基础上,利用下表装置分别进行实验5~8,并记录数据。
| 装置 | 实验序号 | 操作 | 电压表读数 |
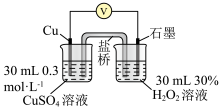 | 5 | 分别向左右两侧烧杯中加入5 mL蒸馏水 | U5 |
| 6 | 向左侧烧杯中加入5.0 mL0.3 mol/L H2SO4溶液,右侧烧杯中加入5 mL蒸馏水 | U6 | |
| 7 | ___________ | U7 | |
| 8 | 向左侧烧杯中逐滴加入5 mL浓氨水,右侧烧杯中加入5 mL蒸馏水 | U8 |
②实验8左侧烧杯中加入5 mL浓氨水(过量)时可观察到的实验现象是
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
您最近一年使用:0次
7 . 已知Cu与 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)硫酸溶液的配制
①配制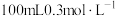 的
的 溶液,需要
溶液,需要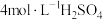 溶液的体积为
溶液的体积为___________ mL(计算结果保留一位小数)。
②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是___________ (填仪器名称)。
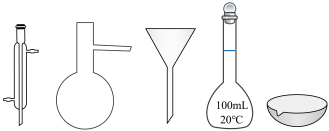
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
已知:本实验条件下, 对电压的影响可忽略。
对电压的影响可忽略。
①根据表中信息,补充数据:
___________ 。
②由实验2和4可知,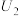
___________ 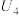 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。
(3)由(2)中实验结果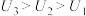 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下, 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
②该实验装置中盐桥的作用为___________ 。
③若实验结果为: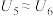 、
、___________ ,说明猜想2不成立,猜想1成立。
(4)已知Cu与 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:___________ 。
(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为___________ 。
 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:I.实验准备
(1)硫酸溶液的配制
①配制
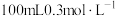 的
的 溶液,需要
溶液,需要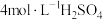 溶液的体积为
溶液的体积为②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是

II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
| 实验装置 | 实验序号 | 烧杯中所加的试剂 | 电压表的读数 | ||
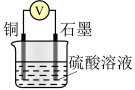 | 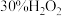 |  硫酸溶液 硫酸溶液 |  | ||
| V/mL | V/mL | V/mL | |||
| 1 | 30.0 | / | 10.0 | 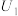 | |
| 2 | 30.0 | 1.0 | 9.0 | 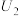 | |
| 3 | 30.0 | 2.0 | 8.0 |  | |
| 4 | 30.0 | 1.0 |  | 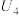 | |
 对电压的影响可忽略。
对电压的影响可忽略。①根据表中信息,补充数据:

②由实验2和4可知,
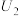
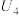 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。(3)由(2)中实验结果
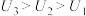 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,
 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
| 实验装置 | 实验序号 | 实验操作 | 电压表的读数 |
 | 5 | / |  |
| 6 | 向①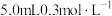 硫酸溶液 硫酸溶液 | 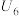 | |
| 7 | 向另一侧烧杯中滴加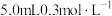 硫酸溶液 硫酸溶液 | 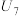 |
③若实验结果为:
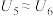 、
、(4)已知Cu与
 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为
您最近一年使用:0次
名校
解题方法
8 . 某同学设计了如下装置用于制取SO2和验证SO2的性质。
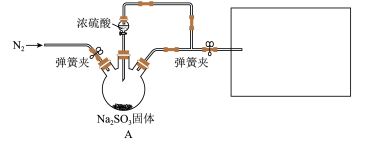
已知:Fe3+具有一定氧化性。
(1)装置 中发生反应的化学方程式为
中发生反应的化学方程式为_______ 。
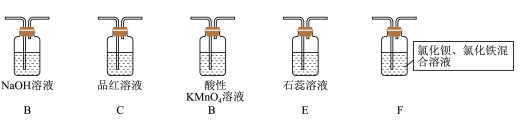
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
_______ (填装置字母,还原性设计两个装置)。
(3)实验前必须鼓入N2,目的是_______ 。
(4)装置F中产生了白色沉淀,其成分是_______ (化学式),分析F中产生白色沉淀原因_______ 。
(5)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g样品,配成100mL溶液;取其中的25.00mL溶液,与0.2000mol/L酸性KMnO4溶液发生以下反应:2MnO +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为
+3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为_______ (保留三位有效数字)。
(6)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示:
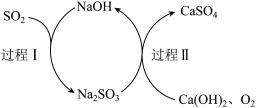
写出过程I的离子反应方程式_______ 。


已知:Fe3+具有一定氧化性。
(1)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
(3)实验前必须鼓入N2,目的是
(4)装置F中产生了白色沉淀,其成分是
(5)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g样品,配成100mL溶液;取其中的25.00mL溶液,与0.2000mol/L酸性KMnO4溶液发生以下反应:2MnO
 +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为
+3H2O,实验消耗KMnO4溶液20.00mL,以上样品中Na2SO3的质量分数为(6)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示:

写出过程I的离子反应方程式
您最近一年使用:0次
解题方法
9 . 化学消毒剂能够有效阻断病毒的传播与扩散。本题中,将探讨2种常见的消毒剂:
Ⅰ.二氧化氯 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于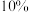 就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组按照文献中制备 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
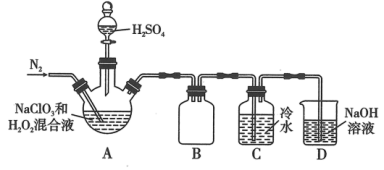
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是_______ 。
②装置A中,装 溶液的仪器名称为
溶液的仪器名称为_______ 。
(2)测定装置 中
中 溶液的浓度:取
溶液的浓度:取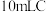 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化(
酸化( ),然后加入
),然后加入_______ 作指示剂,用 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液(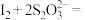 2I-+S4O
2I-+S4O ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为 ,通过计算可知
,通过计算可知 中
中 溶液的浓度为
溶液的浓度为_______  。
。
Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是 和
和 。
。
资料: 的电离常数
的电离常数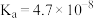 ;
; 的电离常数
的电离常数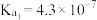 ,
,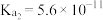 ;
; 的氧化性和杀菌消毒效果强于
的氧化性和杀菌消毒效果强于 。
。
(3)84消毒液溶液呈_______ (填“酸性”或“碱性”)。
(4)84消毒液可由氯气与 溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的
溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的 ,请运用平衡移动原理解释
,请运用平衡移动原理解释 的作用
的作用_______ 。
(5)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为_______ 。
Ⅰ.二氧化氯
 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于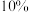 就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:(1)某小组按照文献中制备
 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置A中,装
 溶液的仪器名称为
溶液的仪器名称为(2)测定装置
 中
中 溶液的浓度:取
溶液的浓度:取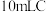 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化(
酸化( ),然后加入
),然后加入 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液(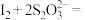 2I-+S4O
2I-+S4O ),当看到
),当看到 ,通过计算可知
,通过计算可知 中
中 溶液的浓度为
溶液的浓度为 。
。Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是
 和
和 。
。资料:
 的电离常数
的电离常数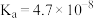 ;
; 的电离常数
的电离常数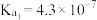 ,
,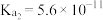 ;
; 的氧化性和杀菌消毒效果强于
的氧化性和杀菌消毒效果强于 。
。(3)84消毒液溶液呈
(4)84消毒液可由氯气与
 溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的
溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的 ,请运用平衡移动原理解释
,请运用平衡移动原理解释 的作用
的作用(5)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
您最近一年使用:0次
10 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
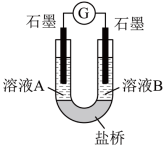
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
343次组卷
|
4卷引用:北京市门头沟区2020届高三3月综合练习化学试题
北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究江苏省昆山中学2022-2023学年高一下学期期中考试化学试题



