名校
解题方法
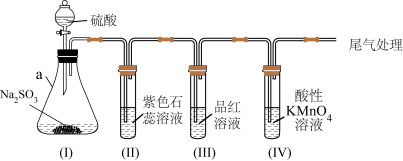
1 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次
2 . Ⅰ.二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
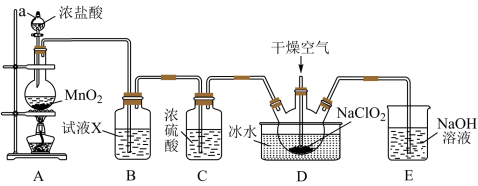
(1)装置A中反应的化学方程式为___________ 。
(2)试剂X是___________ 。
(3)装置D中冰水的主要作用是_______ ,装置D内发生反应的化学方程式为________ 。
(4)工业上对氯气的需求量很大。常利用电解饱和食盐水的方法来制取氯气,该反应的化学方程式为___________ 。
(5)工业上,用双氧水与NaClO3在稀硫酸酸化下反应制备ClO2,则反应的化学方程式为___________ 。
(6)已知NaClO2饱和溶液在不同温度时析出的晶体情况如表。
利用NaClO2溶液制得NaClO2晶体的操作步骤:_______ 、38~60℃的温水洗涤、低于60℃干燥。
Ⅱ.某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO:相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
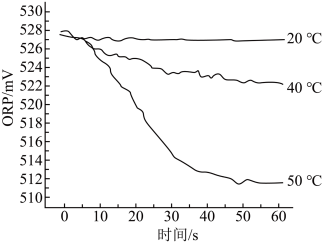
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。
(7)①已知白醋显酸性,不具有漂白性。实验①②现象不同的原因是___________ 。
②实验表明,向84消毒液中加入较多稀盐酸时会产生氯气,生成氯气的方程式是___________ 。
③由实验③可得不同温度下ORP值不同的原因可能是___________ 。
(8)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为___________ mol/L。

(1)装置A中反应的化学方程式为
(2)试剂X是
(3)装置D中冰水的主要作用是
(4)工业上对氯气的需求量很大。常利用电解饱和食盐水的方法来制取氯气,该反应的化学方程式为
(5)工业上,用双氧水与NaClO3在稀硫酸酸化下反应制备ClO2,则反应的化学方程式为
(6)已知NaClO2饱和溶液在不同温度时析出的晶体情况如表。
| 温度 | <38℃ | 38℃~60℃ | >60℃ |
| 析出晶体 | NaClO2·3H2O | NaClO2 | 分解成NaClO3和NaCl |
Ⅱ.某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO:相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。

(7)①已知白醋显酸性,不具有漂白性。实验①②现象不同的原因是
②实验表明,向84消毒液中加入较多稀盐酸时会产生氯气,生成氯气的方程式是
③由实验③可得不同温度下ORP值不同的原因可能是
(8)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
名校
解题方法
3 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:北京市一零一中2021-2022学年高一上学期期中考试化学试题
4 . 某小组通过实验探究NO的某些性质。
(1)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为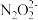 。
。
ⅱ.Ag+与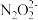 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,_______ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1 mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1 mol/L的AgNO3溶液,_______ (填实验现象)。
上述实验证明NO有氧化性。实验Ⅱ的目的是_______ 。
③写出NO与碱性Na2SO3溶液反应的离子方程式_______ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据实验Ⅳ得到的结论是:_______ 。
(2)某同学结合所学知识,设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用过量小苏打溶液吸收废气中的SO2,反应的化学方程式是_______ 。
②再向生成的溶液中加入一定量_______ ,以此溶液来吸收NO气体。
(1)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为
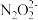 。
。ⅱ.Ag+与
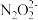 反应生成黄色沉淀。
反应生成黄色沉淀。①检验
 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1 mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1 mol/L的AgNO3溶液,
上述实验证明NO有氧化性。实验Ⅱ的目的是
③写出NO与碱性Na2SO3溶液反应的离子方程式
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据实验Ⅳ得到的结论是:
(2)某同学结合所学知识,设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用过量小苏打溶液吸收废气中的SO2,反应的化学方程式是
②再向生成的溶液中加入一定量
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
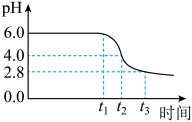
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
364次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
6 . “84”消毒液(主要成分为 和
和 )是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
)是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
I.制备“84消毒液

(1)盛装 仪器的名称为
仪器的名称为___________ ;选择合适装置,按气流从左至右,导管连接顺序为a→___________ →b(填小写字母)。
(2)装置A中反应的离子方程式为___________ ,装置B的作用是___________ 。
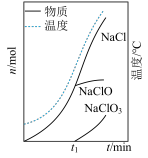
(3)装置E中得到“84”消毒液的化学方程式为___________ 。装置E中生成物的物质的量和溶液的温度随时间的变化如图所示,经分析发现实验过程中装置E中温度计的温度上升过快会导致产物中存在杂质,为避免此状况的发生,应进行的操作为___________ 。
(4)工业上是将氯气通入到 的
的 溶液中来制备“84”消毒液,则生产
溶液中来制备“84”消毒液,则生产 该溶液理论上至少需消耗氯气的质量为
该溶液理论上至少需消耗氯气的质量为___________  (保留整数)。
(保留整数)。
II.探究“84消毒液”的漂白性
资料:i.相同浓度时, 氧化性强于
氧化性强于 ;
;
ii. 反应水溶液中所有物质表现出来的氧化-还原性,
反应水溶液中所有物质表现出来的氧化-还原性, 越大,氧化性越强。
越大,氧化性越强。
某小组同学进行了如下实验:
①向 “84消毒液”中加入
“84消毒液”中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
②向 “84消毒液”中加入
“84消毒液”中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
③向 “84消毒液”中加入
“84消毒液”中加入 浓盐酸后,观察到大量黄绿色气体产生。
浓盐酸后,观察到大量黄绿色气体产生。
④测得“84消毒液”在不同温度时 随时间的变化曲线如下图。
随时间的变化曲线如下图。

(5)已知白醋显酸性,不具有漂白性。实验①、②现象不同的原因是___________ 。
(6)实验③现象表明,向“84消毒液”中加入浓盐酸时会产生氯气,该反应的离子方程式为_____ 。
(7)由实验④可得出的结论是 值与温度有关,且温度越高,
值与温度有关,且温度越高, 值越低。
值越低。 不同的原因可能是
不同的原因可能是___________ 。
 和
和 )是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
)是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。I.制备“84消毒液

(1)盛装
 仪器的名称为
仪器的名称为(2)装置A中反应的离子方程式为
(3)装置E中得到“84”消毒液的化学方程式为

(4)工业上是将氯气通入到
 的
的 溶液中来制备“84”消毒液,则生产
溶液中来制备“84”消毒液,则生产 该溶液理论上至少需消耗氯气的质量为
该溶液理论上至少需消耗氯气的质量为 (保留整数)。
(保留整数)。II.探究“84消毒液”的漂白性
资料:i.相同浓度时,
 氧化性强于
氧化性强于 ;
;ii.
 反应水溶液中所有物质表现出来的氧化-还原性,
反应水溶液中所有物质表现出来的氧化-还原性, 越大,氧化性越强。
越大,氧化性越强。某小组同学进行了如下实验:
①向
 “84消毒液”中加入
“84消毒液”中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。②向
 “84消毒液”中加入
“84消毒液”中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。③向
 “84消毒液”中加入
“84消毒液”中加入 浓盐酸后,观察到大量黄绿色气体产生。
浓盐酸后,观察到大量黄绿色气体产生。④测得“84消毒液”在不同温度时
 随时间的变化曲线如下图。
随时间的变化曲线如下图。
(5)已知白醋显酸性,不具有漂白性。实验①、②现象不同的原因是
(6)实验③现象表明,向“84消毒液”中加入浓盐酸时会产生氯气,该反应的离子方程式为
(7)由实验④可得出的结论是
 值与温度有关,且温度越高,
值与温度有关,且温度越高, 值越低。
值越低。 不同的原因可能是
不同的原因可能是
您最近一年使用:0次
名校
解题方法
7 . 某同学从物质类别、元素价态的角度,预测 和
和 部分化学性质。
部分化学性质。
(1)从物质类别角度, 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为___________ 。
(2)从硫元素的价态角度分析, 既有氧化性又有还原性,
既有氧化性又有还原性,___________ 。
①将 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是___________ 。
A. B.S C.
B.S C. D.
D.
② 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为___________ 。
(3)查阅资料后发现, 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是___________ 。但在实验过程中,他并没有检测到该气体生成,可能的原因是___________ 。
 和
和 部分化学性质。
部分化学性质。(1)从物质类别角度,
 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为(2)从硫元素的价态角度分析,
 既有氧化性又有还原性,
既有氧化性又有还原性,①将
 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是A.
 B.S C.
B.S C. D.
D.
②
 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为(3)查阅资料后发现,
 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
您最近一年使用:0次
名校
解题方法
8 . 水溶液广泛存在于生命体及其赖以生存的环境中,研究水溶液的性质及反应有重要意义。室温下,相关酸的电离平衡常数如下表所示:
回答下列问题。
(1) 的电离方程式是
的电离方程式是________________________ 。
(2)pH相同的 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
______ 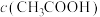 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
(3)室温下,用标准NaOH溶液滴定未知浓度的 溶液。
溶液。
①溶液中的
______ (填“增大”“减小”“不变”或“无法判断”)。
② 溶液显
溶液显______ (填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:____________ 。
③当滴加NaOH溶液至溶液中的 ,此时溶液中的pH
,此时溶液中的pH______ 7(填“<”“=”或“>”),判断的依据__________________ 。
(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于 。
。
①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为__________________ ,请结合电离平衡常数解释消毒效果增强的原因____________ 。
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用__________________ 。
| 酸 |  |  | HClO |  |
电离平衡常数 |  |  |  | 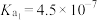  |
(1)
 的电离方程式是
的电离方程式是(2)pH相同的
 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
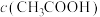 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。(3)室温下,用标准NaOH溶液滴定未知浓度的
 溶液。
溶液。①溶液中的

②
 溶液显
溶液显③当滴加NaOH溶液至溶液中的
 ,此时溶液中的pH
,此时溶液中的pH(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于
 。
。①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用
您最近一年使用:0次
解题方法
9 . 某化学兴趣小组设计如下实验探究硫代硫酸钠( )的化学性质。
)的化学性质。
资料:① 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②
回答下列问题:
I.实验一 溶液的酸碱性
溶液的酸碱性
(1)可用_______ 试纸测定 该溶液的酸碱性。
该溶液的酸碱性。
II.实验二 溶液的还原性
溶液的还原性
取溴水于试管中,滴加 溶液至溴水褪色。
溶液至溴水褪色。
(2)该反应的离子方程式为_______ 。
III.实验三 探究 的热分解产物
的热分解产物
设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。
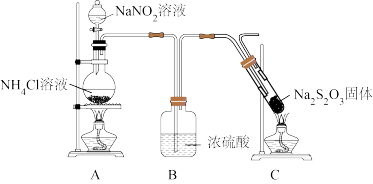
(3)实验开始时,应先点燃_______ 处的酒精灯,目的是_______ 。
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点: 、S乙观点:
、S乙观点: 、
、 、S
、S
丙观点: 、S丁观点:
、S丁观点: 、
、 、S
、S
①为了证明丙观点是错误的,需检验产物中有 ,实验方案是
,实验方案是_______ 。
②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有 ,理由是
,理由是_______ 。
③甲和乙观点是错误的,说明理由_______ (任选一种观点回答)。
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:_______ 。
 )的化学性质。
)的化学性质。资料:①
 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②

回答下列问题:
I.实验一
 溶液的酸碱性
溶液的酸碱性(1)可用
 该溶液的酸碱性。
该溶液的酸碱性。II.实验二
 溶液的还原性
溶液的还原性取溴水于试管中,滴加
 溶液至溴水褪色。
溶液至溴水褪色。(2)该反应的离子方程式为
III.实验三 探究
 的热分解产物
的热分解产物设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。

(3)实验开始时,应先点燃
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点:
 、S乙观点:
、S乙观点: 、
、 、S
、S丙观点:
 、S丁观点:
、S丁观点: 、
、 、S
、S①为了证明丙观点是错误的,需检验产物中有
 ,实验方案是
,实验方案是②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有
 ,理由是
,理由是③甲和乙观点是错误的,说明理由
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:
您最近一年使用:0次
解题方法
10 . 完成下列问题。
(1)室温下,甲同学取相同体积的 和
和 溶液混合,探究浓度对反应速率的影响,实验记录如下:
溶液混合,探究浓度对反应速率的影响,实验记录如下:
①该反应的化学方程式为_______ 。
②通过分析比较上表数据,得到的结论是_______ 。
(2)乙同学用 替代
替代 进行上述实验,未观察到溶液变为棕黄色,推测原因是酸性对
进行上述实验,未观察到溶液变为棕黄色,推测原因是酸性对 氧化性有影响,乙同学提出猜测并进行如下探究。
氧化性有影响,乙同学提出猜测并进行如下探究。
提出猜想:其他条件相同时,酸性越强,氧化剂的氧化性越强。
查阅资料:原电池中负极反应一定时,正极氧化剂的氧化性越强,则两极之间电压越高。
设计实验、验证猜想:利用如图装置进行下表实验1~4,记录数据。

①实验1和2中正极的电极反应式为_______ 。
②由实验1和2可知,酸性越强, 的氧化性越强,作出该判断的依据是
的氧化性越强,作出该判断的依据是_______ 。
③测得 ,说明酸性对
,说明酸性对 的氧化性几乎无影响,解释原因:
的氧化性几乎无影响,解释原因:_______ 。
实验结论:若氧化剂被还原时有 参加反应,酸性越强,氧化剂的氧化性越强;若氧化剂被还原时没有
参加反应,酸性越强,氧化剂的氧化性越强;若氧化剂被还原时没有 参加反应,酸性对氧化剂的氧化性几乎没有影响。
参加反应,酸性对氧化剂的氧化性几乎没有影响。
迁移拓展:综合上述探究结果,丙同学进一步提出猜想,其他条件相同时,氧化剂浓度越大,其氧化性越强。
(3)结合乙同学的实验2,丙同学补充进行实验5,验证猜想成立,完成下表中的内容:
猜想成立的依据是:_______ 。
(1)室温下,甲同学取相同体积的
 和
和 溶液混合,探究浓度对反应速率的影响,实验记录如下:
溶液混合,探究浓度对反应速率的影响,实验记录如下:| 实验编号 | 1 | 2 | 3 | 4 | 5 |
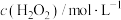 |  |  |  |  |  |
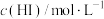 |  |  |  |  |  |
从混合到出现棕黄色时间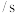 | 13 | 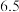 | 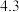 |  |  |
②通过分析比较上表数据,得到的结论是
(2)乙同学用
 替代
替代 进行上述实验,未观察到溶液变为棕黄色,推测原因是酸性对
进行上述实验,未观察到溶液变为棕黄色,推测原因是酸性对 氧化性有影响,乙同学提出猜测并进行如下探究。
氧化性有影响,乙同学提出猜测并进行如下探究。提出猜想:其他条件相同时,酸性越强,氧化剂的氧化性越强。
查阅资料:原电池中负极反应一定时,正极氧化剂的氧化性越强,则两极之间电压越高。
设计实验、验证猜想:利用如图装置进行下表实验1~4,记录数据。
| 序号 | 溶液 | 电压表读数 |
| 1 | 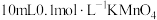 溶液、3滴稀 溶液、3滴稀 | 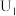 |
| 2 | 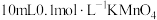 溶液、3滴浓 溶液、3滴浓 |  |
| 3 | 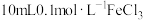 溶液、3滴稀 溶液、3滴稀 | 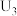 |
| 4 | 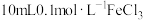 溶液、3滴浓 溶液、3滴浓 | 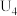 |

①实验1和2中正极的电极反应式为
②由实验1和2可知,酸性越强,
 的氧化性越强,作出该判断的依据是
的氧化性越强,作出该判断的依据是③测得
 ,说明酸性对
,说明酸性对 的氧化性几乎无影响,解释原因:
的氧化性几乎无影响,解释原因:实验结论:若氧化剂被还原时有
 参加反应,酸性越强,氧化剂的氧化性越强;若氧化剂被还原时没有
参加反应,酸性越强,氧化剂的氧化性越强;若氧化剂被还原时没有 参加反应,酸性对氧化剂的氧化性几乎没有影响。
参加反应,酸性对氧化剂的氧化性几乎没有影响。迁移拓展:综合上述探究结果,丙同学进一步提出猜想,其他条件相同时,氧化剂浓度越大,其氧化性越强。
(3)结合乙同学的实验2,丙同学补充进行实验5,验证猜想成立,完成下表中的内容:
| 序号 | 溶液a | 电压表读数 |
| 5 |  |
您最近一年使用:0次