解题方法
1 . 某实验小组进行Na2SO3的有关探究活动。
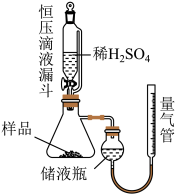
I.久置样品纯度的测定
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是_______ ;
(2)使用恒压滴液漏斗添加稀硫酸的优点_______ ;
(3)储液瓶中盛装的液体试剂是_______ ,该实验小组某个同学在第④步读数时未让储液瓶和量气管两边液面持平,对测量结果的影响是_______ ;(填“偏高”“偏低”“不变”)
(4)若该实验条件下的气体摩尔体积为24.5L/mol,则 纯度为
纯度为_______ (用含V1、V2、m的式子表达)。
II.探究CuCl2溶液与 溶液反应
溶液反应
将1mL0.2mol/L 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
查阅资料:
i.橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii.原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为_______ ;
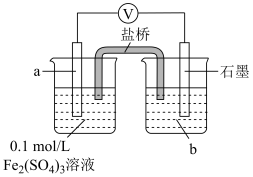
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性。
则X为_______ , >
> ,则说明Cl-能提高Cu2+的氧化性。
,则说明Cl-能提高Cu2+的氧化性。
I.久置样品纯度的测定
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是
(2)使用恒压滴液漏斗添加稀硫酸的优点
(3)储液瓶中盛装的液体试剂是
(4)若该实验条件下的气体摩尔体积为24.5L/mol,则
 纯度为
纯度为II.探究CuCl2溶液与
 溶液反应
溶液反应将1mL0.2mol/L
 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。查阅资料:
i.橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii.原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性。
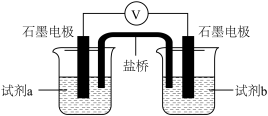
| 试剂a | 试剂b | 电压表读数 |
0.2mol/L 溶液 溶液 | 0.2mol/L 溶液 溶液 | E1 |
0.2mol/L 溶液 溶液 | X | E2 |
 >
> ,则说明Cl-能提高Cu2+的氧化性。
,则说明Cl-能提高Cu2+的氧化性。
您最近一年使用:0次
解题方法
2 . 某化学小组探究硫酸铁铵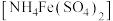 与
与 、
、 的反应。
的反应。
已知: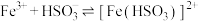 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
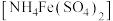 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入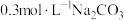 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
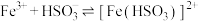 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
名校
解题方法
3 . 硫代硫酸银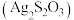 为白色固体,受热易分解且具有还原性,可用作乙烯抑制剂。某课外小组向
为白色固体,受热易分解且具有还原性,可用作乙烯抑制剂。某课外小组向 溶液中逐滴滴加
溶液中逐滴滴加 溶液制备
溶液制备 。实验记录如下。
。实验记录如下。
已知:Ⅰ.①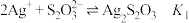
②
Ⅱ.相关物质的 :
:

(1) 中配位原子为
中配位原子为_______ ,配体阴离子的空间构型是_______ 。
(2)实验中沉淀溶解的总反应为: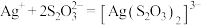 ,其平衡常数
,其平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
(3)用平衡移动原理解释实验中随 溶液滴入,又产生白色沉淀的原因是
溶液滴入,又产生白色沉淀的原因是_______ 。
(4)设计如下实验证明实验过程中产生的沉淀除了含有 外,还含有S和
外,还含有S和 。
。
取少量沉淀,加入足量_______ (填标号),充分振荡,过滤得滤液a和固体b。
A.乙醇 B.乙醚 C.丙酮 D.
i.取滤液a蒸馏可得黄色物质,证明沉淀中含有S。
ii.取固体b,_______ ,证明沉淀中含有 。(可供选择的试剂:稀硫酸、稀盐酸、稀硝酸、
。(可供选择的试剂:稀硫酸、稀盐酸、稀硝酸、 溶液)
溶液)
(5)查阅资料可知: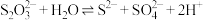 。实验证明:实验中S产生的主要原因是
。实验证明:实验中S产生的主要原因是 被
被 氧化而非被
氧化而非被 氧化。从反应速率的角度解释其原因:i.等浓度
氧化。从反应速率的角度解释其原因:i.等浓度 的氧化性大于
的氧化性大于 ,氧化
,氧化 的速率更快;ii.
的速率更快;ii._______ 。
(6)制备 时需及时分离出白色沉淀的原因是
时需及时分离出白色沉淀的原因是_______ 。
(7) 中的银元素在乙烯抑制剂中发挥重要的作用。该小组同学测定制得的白色固体中银的质量分数,具体实验过程如下。取
中的银元素在乙烯抑制剂中发挥重要的作用。该小组同学测定制得的白色固体中银的质量分数,具体实验过程如下。取 白色固体,加入适量硝酸充分反应,所得溶液加水稀释至
白色固体,加入适量硝酸充分反应,所得溶液加水稀释至 。再取
。再取 稀溶液于锥形瓶中,加入指示剂用
稀溶液于锥形瓶中,加入指示剂用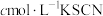 溶液进行滴定,重复滴定2~3次,平均消耗
溶液进行滴定,重复滴定2~3次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知:
①选用的指示剂是_______ (填标号)。
A. B.
B. C.
C. D.
D.
②若未加入适量硝酸充分反应,会导致测量结果_______ (填“偏高”、“偏低”或“无影响”)。
③白色固体中银的质量分数为_______ %。
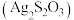 为白色固体,受热易分解且具有还原性,可用作乙烯抑制剂。某课外小组向
为白色固体,受热易分解且具有还原性,可用作乙烯抑制剂。某课外小组向 溶液中逐滴滴加
溶液中逐滴滴加 溶液制备
溶液制备 。实验记录如下。
。实验记录如下。| 操作 | 试剂a | 试剂b | 实验现象 |
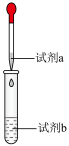 |  溶液 溶液 | 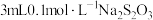 溶液 溶液 | 开始有白色沉淀,振荡后溶解,随 溶液滴入,又产生白色沉淀,而后沉淀逐渐变成黄色,最终变成黑色 溶液滴入,又产生白色沉淀,而后沉淀逐渐变成黄色,最终变成黑色 |
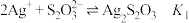
②

Ⅱ.相关物质的
 :
:| 物质 |  |  |  |
 | 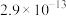 | 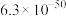 |  |

(1)
 中配位原子为
中配位原子为(2)实验中沉淀溶解的总反应为:
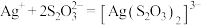 ,其平衡常数
,其平衡常数
 、
、 的代数式表示)。
的代数式表示)。(3)用平衡移动原理解释实验中随
 溶液滴入,又产生白色沉淀的原因是
溶液滴入,又产生白色沉淀的原因是(4)设计如下实验证明实验过程中产生的沉淀除了含有
 外,还含有S和
外,还含有S和 。
。取少量沉淀,加入足量
A.乙醇 B.乙醚 C.丙酮 D.

i.取滤液a蒸馏可得黄色物质,证明沉淀中含有S。
ii.取固体b,
 。(可供选择的试剂:稀硫酸、稀盐酸、稀硝酸、
。(可供选择的试剂:稀硫酸、稀盐酸、稀硝酸、 溶液)
溶液)(5)查阅资料可知:
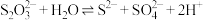 。实验证明:实验中S产生的主要原因是
。实验证明:实验中S产生的主要原因是 被
被 氧化而非被
氧化而非被 氧化。从反应速率的角度解释其原因:i.等浓度
氧化。从反应速率的角度解释其原因:i.等浓度 的氧化性大于
的氧化性大于 ,氧化
,氧化 的速率更快;ii.
的速率更快;ii.(6)制备
 时需及时分离出白色沉淀的原因是
时需及时分离出白色沉淀的原因是(7)
 中的银元素在乙烯抑制剂中发挥重要的作用。该小组同学测定制得的白色固体中银的质量分数,具体实验过程如下。取
中的银元素在乙烯抑制剂中发挥重要的作用。该小组同学测定制得的白色固体中银的质量分数,具体实验过程如下。取 白色固体,加入适量硝酸充分反应,所得溶液加水稀释至
白色固体,加入适量硝酸充分反应,所得溶液加水稀释至 。再取
。再取 稀溶液于锥形瓶中,加入指示剂用
稀溶液于锥形瓶中,加入指示剂用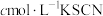 溶液进行滴定,重复滴定2~3次,平均消耗
溶液进行滴定,重复滴定2~3次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知:
①选用的指示剂是
A.
 B.
B. C.
C. D.
D.
②若未加入适量硝酸充分反应,会导致测量结果
③白色固体中银的质量分数为
您最近一年使用:0次
解题方法
4 . 某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为____________________ 。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有_______ (填:“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:__ MnO +
+__ H2C2O4+__ H+=__ Mn2++__ CO2↑+__ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是____________________ 。乙二酸分解的化学方程式为________________ 。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________ 。
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:__________________ 。
(6)设计实验证明草酸的酸性比碳酸强:__________________ 。
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现紫红色逐渐褪去,说明乙二酸具有
 +
+(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:上述装置中,D的作用是
(4)该小组同学将2.52g草酸晶体(H2C2O4·2H2O)加入到100mL 0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(5)Na2C2O4溶液中离子的浓度由大到小的顺序为:
(6)设计实验证明草酸的酸性比碳酸强:
您最近一年使用:0次
解题方法
5 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次
名校
6 . 某研究小组利用下图所示装置探究氯气的性质和氯气的刷备。
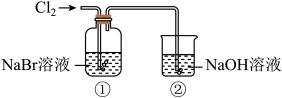
Ⅰ.氯气性质的探究
(1)实验室用 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是___________ 。利用了 的
的___________ (填“氧化性”或“还原性”)
(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是___________ 。
(3)②中 溶液的作用是
溶液的作用是___________ ;发生反应的离子方程式是___________ 。若用排空气法收集一瓶氯气,可利用方框中的装置代替装置①,请将方框中的收集装置补充完整___________ 。
(4)取一支试管,加入 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是___________ 。
Ⅱ.氯气制备的探究
某化学小组研究盐酸被 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:
资料: 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
(5)①已知 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是___________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是___________ 。
③Ⅲ中无明显现象的原因,可能是 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是___________ ;将ⅰ、ⅱ作对比,得出的结论是___________ 。

Ⅰ.氯气性质的探究
(1)实验室用
 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是 的
的(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是
(3)②中
 溶液的作用是
溶液的作用是
(4)取一支试管,加入
 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是Ⅱ.氯气制备的探究
某化学小组研究盐酸被
 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将 和 和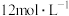 浓盐酸混合 浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅱ | 加热 和 和 稀盐酸混合物 稀盐酸混合物 | 无明显现象 |
 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。(5)①已知
 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是
 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
解题方法
7 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
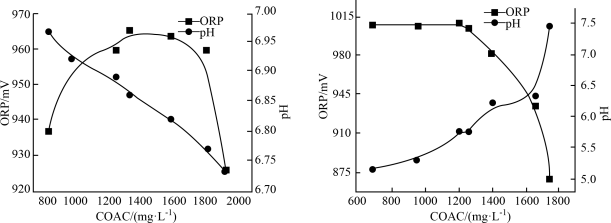
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
名校
解题方法
8 . 某小组探究含 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。
资料:
i.含 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、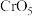 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。
ii. 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中, 不能氧化
不能氧化 价格元素。
价格元素。
实验操作及现象如下:
(1)已知 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是_____ (填字母)。
A. 和
和 的浓度相同 B.
的浓度相同 B.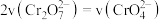 C.溶液的颜色不变
C.溶液的颜色不变
(2)已知 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(4)Ⅱ中,继续滴入 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是_____ 。
(5)Ⅱ中,继续滴入 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。
①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入 溶液前增加一步操作:
溶液前增加一步操作:_____ 。然后滴入 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为_____ 色。
②乙同学通过原电池原理进一步研究碱性环境对 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,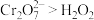 ;碱性条件下,
;碱性条件下,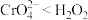
(6)此外,生产中常用 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用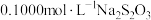 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为_____  。
。
 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。资料:
i.含
 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、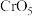 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。ii.
 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。iii.在碱性环境中,
 不能氧化
不能氧化 价格元素。
价格元素。实验操作及现象如下:
| 装置 | 步骤 | 操作 | 现象 |
2mL0.0125 K2Cr2O7溶液 | Ⅰ | 先滴入稀疏酸至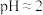 ,再滴入5滴 ,再滴入5滴 溶液,振荡 溶液,振荡 | 溶液橙色加深。滴入 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴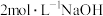 溶液,边滴,边振荡 溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
(1)已知
 (橙色)
(橙色) (黄色)
(黄色) 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是A.
 和
和 的浓度相同 B.
的浓度相同 B.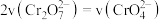 C.溶液的颜色不变
C.溶液的颜色不变(2)已知
 (橙色)
(橙色) (黄色)
(黄色) 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是
(4)Ⅱ中,继续滴入
 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是(5)Ⅱ中,继续滴入
 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入
 溶液前增加一步操作:
溶液前增加一步操作: 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为②乙同学通过原电池原理进一步研究碱性环境对
 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,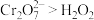 ;碱性条件下,
;碱性条件下,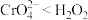
(6)此外,生产中常用
 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用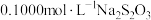 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为 。
。
您最近一年使用:0次
9 . 某小组探究 、
、 能否将
能否将 氧化,甲同学设计了如下实验:
氧化,甲同学设计了如下实验:
(1) 中反应的离子方程式为
中反应的离子方程式为______ ,说明氧化性: 。
。
(2)乙同学认为: 中溶液滴加淀粉溶液,未变蓝,原因是
中溶液滴加淀粉溶液,未变蓝,原因是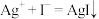 ,于是设计了如下实验。
,于是设计了如下实验。
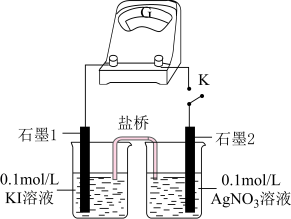
①盐桥中电解质可以使用______ 。
A. B.
B.
②K闭合时,指针有偏转,则“石墨2”作______ 极。
A.正 B.负
“石墨2”的电极反应式为______ 。
③指针归零后,向右侧烧杯中滴加 溶液或向左侧烧杯中滴加
溶液或向左侧烧杯中滴加 溶液,指针均有偏转,说明
溶液,指针均有偏转,说明 (或
(或 )浓度越大,溶液的氧化性(或还原性)越
)浓度越大,溶液的氧化性(或还原性)越______ 。
A.强 B.弱
④乙同学查阅资料,已知 ,当等体积等浓度的
,当等体积等浓度的 和
和 溶液混合时,溶液中
溶液混合时,溶液中
______  ,溶液中
,溶液中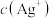 和
和 很小,
很小, 氧化性和
氧化性和 的还原性很弱,二者直接接触,不发生氧化还原反应。
的还原性很弱,二者直接接触,不发生氧化还原反应。
⑤丙同学测得 溶液的
溶液的 ,认为乙同学的实验中也可能是硝酸氧化了
,认为乙同学的实验中也可能是硝酸氧化了 ,请设计实验方案验证丙同学的猜想:
,请设计实验方案验证丙同学的猜想:______ 。
 、
、 能否将
能否将 氧化,甲同学设计了如下实验:
氧化,甲同学设计了如下实验: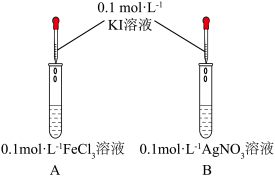 | 实验现象 |
| A中溶液呈黄色,滴加淀粉溶液,溶液变蓝 | |
| B中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
 中反应的离子方程式为
中反应的离子方程式为 。
。(2)乙同学认为:
 中溶液滴加淀粉溶液,未变蓝,原因是
中溶液滴加淀粉溶液,未变蓝,原因是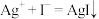 ,于是设计了如下实验。
,于是设计了如下实验。
①盐桥中电解质可以使用
A.
 B.
B.
②K闭合时,指针有偏转,则“石墨2”作
A.正 B.负
“石墨2”的电极反应式为
③指针归零后,向右侧烧杯中滴加
 溶液或向左侧烧杯中滴加
溶液或向左侧烧杯中滴加 溶液,指针均有偏转,说明
溶液,指针均有偏转,说明 (或
(或 )浓度越大,溶液的氧化性(或还原性)越
)浓度越大,溶液的氧化性(或还原性)越A.强 B.弱
④乙同学查阅资料,已知
 ,当等体积等浓度的
,当等体积等浓度的 和
和 溶液混合时,溶液中
溶液混合时,溶液中
 ,溶液中
,溶液中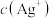 和
和 很小,
很小, 氧化性和
氧化性和 的还原性很弱,二者直接接触,不发生氧化还原反应。
的还原性很弱,二者直接接触,不发生氧化还原反应。⑤丙同学测得
 溶液的
溶液的 ,认为乙同学的实验中也可能是硝酸氧化了
,认为乙同学的实验中也可能是硝酸氧化了 ,请设计实验方案验证丙同学的猜想:
,请设计实验方案验证丙同学的猜想:
您最近一年使用:0次
解题方法
10 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
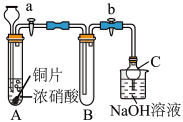
①试管A中反应的离子方程式是___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________ 。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________ 。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________ 。
②B中观察到的主要现象的是_________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________ 。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________ ,则产物是NaNO2。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:

①试管A中反应的离子方程式是
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
您最近一年使用:0次