解题方法
1 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次
解题方法
2 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
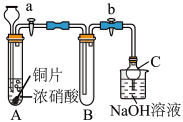
①试管A中反应的离子方程式是___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________ 。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________ 。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________ 。
②B中观察到的主要现象的是_________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________ 。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________ ,则产物是NaNO2。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:

①试管A中反应的离子方程式是
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
您最近一年使用:0次
名校
3 . 某研究小组利用下图所示装置探究氯气的性质和氯气的刷备。
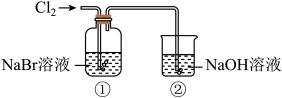
Ⅰ.氯气性质的探究
(1)实验室用 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是___________ 。利用了 的
的___________ (填“氧化性”或“还原性”)
(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是___________ 。
(3)②中 溶液的作用是
溶液的作用是___________ ;发生反应的离子方程式是___________ 。若用排空气法收集一瓶氯气,可利用方框中的装置代替装置①,请将方框中的收集装置补充完整___________ 。
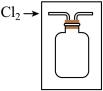
(4)取一支试管,加入 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是___________ 。
Ⅱ.氯气制备的探究
某化学小组研究盐酸被 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:
资料: 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
(5)①已知 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是___________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是___________ 。
③Ⅲ中无明显现象的原因,可能是 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是___________ ;将ⅰ、ⅱ作对比,得出的结论是___________ 。

Ⅰ.氯气性质的探究
(1)实验室用
 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是 的
的(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是
(3)②中
 溶液的作用是
溶液的作用是
(4)取一支试管,加入
 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是Ⅱ.氯气制备的探究
某化学小组研究盐酸被
 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将 和 和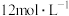 浓盐酸混合 浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅱ | 加热 和 和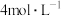 稀盐酸混合物 稀盐酸混合物 | 无明显现象 |
 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。(5)①已知
 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是
 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
解题方法
4 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
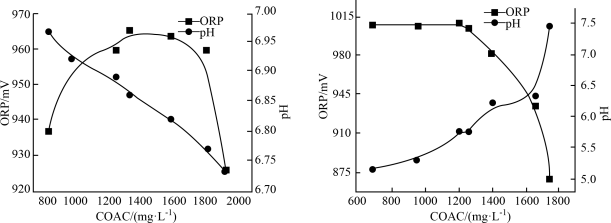
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
名校
解题方法
5 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为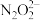 。
。
ⅱ. 与
与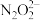 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴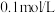 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴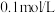 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: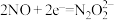 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为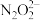 。
。ⅱ.
 与
与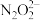 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴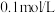 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
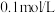 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: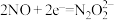 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近一年使用:0次
6 . 某小组探究 、
、 能否将
能否将 氧化,甲同学设计了如下实验:
氧化,甲同学设计了如下实验:
(1) 中反应的离子方程式为
中反应的离子方程式为______ ,说明氧化性: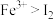 。
。
(2)乙同学认为: 中溶液滴加淀粉溶液,未变蓝,原因是
中溶液滴加淀粉溶液,未变蓝,原因是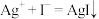 ,于是设计了如下实验。
,于是设计了如下实验。
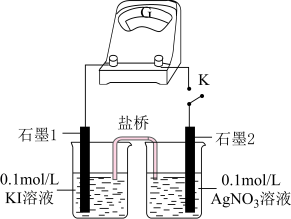
①盐桥中电解质可以使用______ 。
A. B.
B.
②K闭合时,指针有偏转,则“石墨2”作______ 极。
A.正 B.负
“石墨2”的电极反应式为______ 。
③指针归零后,向右侧烧杯中滴加 溶液或向左侧烧杯中滴加
溶液或向左侧烧杯中滴加 溶液,指针均有偏转,说明
溶液,指针均有偏转,说明 (或
(或 )浓度越大,溶液的氧化性(或还原性)越
)浓度越大,溶液的氧化性(或还原性)越______ 。
A.强 B.弱
④乙同学查阅资料,已知 ,当等体积等浓度的
,当等体积等浓度的 和
和 溶液混合时,溶液中
溶液混合时,溶液中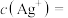
______  ,溶液中
,溶液中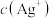 和
和 很小,
很小, 氧化性和
氧化性和 的还原性很弱,二者直接接触,不发生氧化还原反应。
的还原性很弱,二者直接接触,不发生氧化还原反应。
⑤丙同学测得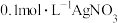 溶液的
溶液的 ,认为乙同学的实验中也可能是硝酸氧化了
,认为乙同学的实验中也可能是硝酸氧化了 ,请设计实验方案验证丙同学的猜想:
,请设计实验方案验证丙同学的猜想:______ 。
 、
、 能否将
能否将 氧化,甲同学设计了如下实验:
氧化,甲同学设计了如下实验: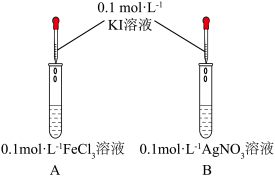 | 实验现象 |
| A中溶液呈黄色,滴加淀粉溶液,溶液变蓝 | |
| B中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
 中反应的离子方程式为
中反应的离子方程式为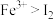 。
。(2)乙同学认为:
 中溶液滴加淀粉溶液,未变蓝,原因是
中溶液滴加淀粉溶液,未变蓝,原因是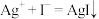 ,于是设计了如下实验。
,于是设计了如下实验。
①盐桥中电解质可以使用
A.
 B.
B.
②K闭合时,指针有偏转,则“石墨2”作
A.正 B.负
“石墨2”的电极反应式为
③指针归零后,向右侧烧杯中滴加
 溶液或向左侧烧杯中滴加
溶液或向左侧烧杯中滴加 溶液,指针均有偏转,说明
溶液,指针均有偏转,说明 (或
(或 )浓度越大,溶液的氧化性(或还原性)越
)浓度越大,溶液的氧化性(或还原性)越A.强 B.弱
④乙同学查阅资料,已知
 ,当等体积等浓度的
,当等体积等浓度的 和
和 溶液混合时,溶液中
溶液混合时,溶液中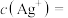
 ,溶液中
,溶液中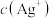 和
和 很小,
很小, 氧化性和
氧化性和 的还原性很弱,二者直接接触,不发生氧化还原反应。
的还原性很弱,二者直接接触,不发生氧化还原反应。⑤丙同学测得
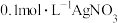 溶液的
溶液的 ,认为乙同学的实验中也可能是硝酸氧化了
,认为乙同学的实验中也可能是硝酸氧化了 ,请设计实验方案验证丙同学的猜想:
,请设计实验方案验证丙同学的猜想:
您最近一年使用:0次
解题方法
7 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取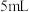 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约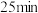 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取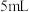 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约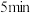 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: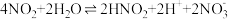
第二步: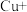 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 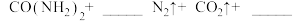 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
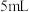 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约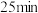 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
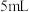 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约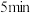 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
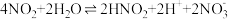
第二步:
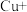 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 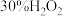 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
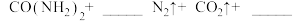 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
8 . 某小组通过实验探究NO的某些性质。
(1)以Cu和 为原料制备NO,反应的化学方程式为
为原料制备NO,反应的化学方程式为__________ 。
(2)判断NO有氧化性的理论依据是__________ 。
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,NO被还原为
溶液会发生氧化还原反应,NO被还原为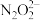 。
。
ⅱ.醋酸银易溶于水,硫酸银微溶于水, 是不溶于水的黄色固体。
是不溶于水的黄色固体。
①选择碱性 溶液的原因是
溶液的原因是__________ 。
②检验 的转化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的转化产物。取少量实验Ⅰ反应后集气瓶中的溶液,__________ (填操作和实验现象)。
③某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量醋酸,再滴加5滴
溶液,加入少量醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量醋酸,再滴加5滴 的
的 溶液,
溶液,__________ (填实验现象)。实验Ⅱ的目的是__________ 。上述实验证明NO有氧化性。
(1)以Cu和
 为原料制备NO,反应的化学方程式为
为原料制备NO,反应的化学方程式为(2)判断NO有氧化性的理论依据是
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,NO被还原为
溶液会发生氧化还原反应,NO被还原为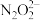 。
。ⅱ.醋酸银易溶于水,硫酸银微溶于水,
 是不溶于水的黄色固体。
是不溶于水的黄色固体。①选择碱性
 溶液的原因是
溶液的原因是②检验
 的转化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的转化产物。取少量实验Ⅰ反应后集气瓶中的溶液,③某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量醋酸,再滴加5滴
溶液,加入少量醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量醋酸,再滴加5滴
 的
的 溶液,
溶液,
您最近一年使用:0次
名校
9 . 某研究小组制备氯气并对产生氯气的反应原理进行探究。
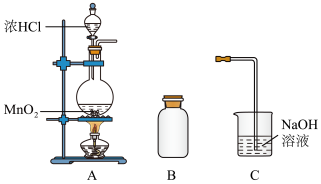
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的_______ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质有_______ (填化学式)。
(3)B用于排空气法收集Cl2,请完善装置B,并用箭头标明进出气体方向_______ 。
(4)该小组对产生氯气的反应原理,设计实验进行如下探究。
结合查阅资料,可知:
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_______ 。
②Ⅱ中发生了分解反应,反应的化学方程式是_______ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质有
(3)B用于排空气法收集Cl2,请完善装置B,并用箭头标明进出气体方向
(4)该小组对产生氯气的反应原理,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是
②Ⅱ中发生了分解反应,反应的化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 某小组通过实验探究NO的某些性质。
(1)从氮元素的价态角度分析,NO有___________ 性。
(2)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,NO被还原为
溶液会发生氧化还原反应,NO被还原为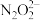 。
。
ⅱ. 与
与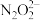 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,___________ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的
溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是___________ 。
③写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和 溶液和加有NaOH的饱和
溶液和加有NaOH的饱和 溶液中,后者集气瓶中液面上升更快。
溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:___________ 。
(3)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,反应的化学方程式是
,反应的化学方程式是___________ 。
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
(1)从氮元素的价态角度分析,NO有
(2)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,NO被还原为
溶液会发生氧化还原反应,NO被还原为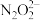 。
。ⅱ.
 与
与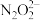 反应生成黄色沉淀。
反应生成黄色沉淀。①检验
 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的
溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的
 溶液,
溶液,上述实验证明NO有氧化性。
实验Ⅱ的目的是
③写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和
 溶液和加有NaOH的饱和
溶液和加有NaOH的饱和 溶液中,后者集气瓶中液面上升更快。
溶液中,后者集气瓶中液面上升更快。根据上述实验所得结论:
(3)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,反应的化学方程式是
,反应的化学方程式是②再向生成的溶液中加入一定量
您最近一年使用:0次



